Capítulo 1
Viva primordium
Imagínate un planeta más o menos del mismo tamaño que el nuestro, más o menos tan lejos de su estrella como nosotros, pero cuya rotación es un poco más rápida, de manera que sus días duran veinte horas. Está cubierto por un océano poco profundo de aguas saladas y no existen los continentes; solo algunos archipiélagos de tierra basáltica negra asoman por la superficie del agua. Su atmósfera no tiene la misma mezcla de gases que la nuestra. Es una capa tóxica y húmeda de nitrógeno, metano y dióxido de carbono.
No hay oxígeno. No hay vida.
Porque este planeta, tal como era el nuestro hace cuatro mil millones de años, es un lugar agreste e inhóspito. Caliente y volcánico. Eléctrico. Tumultuoso.
Pero eso está a punto de cambiar. El agua empieza a acumularse en los cálidos conductos termales de una de las islas más grandes. Todas las superficies están cubiertas de moléculas orgánicas que han llegado a bordo de meteoritos y cometas. Sobre la roca volcánica seca, dichas moléculas seguirán siendo eso, moléculas sin más. Pero cuando se disuelven en el borde de los charcos de agua cálida a través de ciclos húmedos y secos, se desencadena un proceso químico especial. A medida que se concentran los ácidos nucleicos, se convierten en polímeros, de la misma manera en que se forman los cristales de sal cuando se evapora un charco en la orilla del mar. Son las primeras moléculas de ARN del mundo, las predecesoras del ADN. Cuando el charco vuelva a llenarse de agua, ese material genético primitivo quedará encapsulado por ácidos grasos que formarán unas burbujas de jabón microscópicas, las primeras membranas celulares.
No se necesita mucho tiempo, una semana tal vez, para que esos charcos que apenas tienen profundidad estén cubiertos por una espuma amarilla formada por millones de diminutos precursores de células llenos de cadenas cortas de ácidos nucleicos, lo que hoy en día llamamos «genes».
Muchas de esas protocélulas se reciclan, pero algunas sobreviven y empiezan a desarrollar rutas metabólicas primitivas, hasta que al final el ARN comienza a replicarse a sí mismo. Ese punto marca el comienzo de la vida. Ahora que esta se ha desarrollado, en forma de burbujas de jabón de ácidos grasos repletas de material genético, dichas burbujas empiezan a competir para imponerse a las demás. Simplemente, no existen suficientes recursos para todas. Que gane la mejor.
Día tras día, esas formas de vida tan frágiles y microscópicas van evolucionando hasta alcanzar formas más complejas que se extienden hasta ríos y los lagos.
Pero esa diseminación conlleva una amenaza: una sequía prolongada. El nivel de charcos y lagos cubiertos de espuma amarilla disminuye unos cuantos metros durante la estación seca, aunque los lagos siempre se han recuperado cuando vuelve a llover. Sin embargo, este año en concreto y por culpa de la intensa actividad volcánica en el otro lado del planeta, las lluvias anuales no son tan abundantes como de costumbre y las nubes pasan sin dejar ni gota. Los lagos se secan por completo.
Lo que queda es una costra amarilla gruesa en el lecho de los lagos. Es un ecosistema definido no por el aumento y la disminución del nivel anual del agua, sino por una lucha brutal por la supervivencia. Y ahora más que nunca. Es una lucha por el futuro. Porque los organismos que sobrevivan serán los progenitores de todas las formas de vida que se desarrollarán después: arqueas, bacterias, hongos, plantas y animales.
Dentro de esa masa de células moribundas, donde todas tratan de conseguir su cantidad mínima de nutrientes y de humedad para sobrevivir, y de hacer todo lo posible para responder a la atávica llamada de la reproducción, existe una especie única. La llamaremos Magna superstes, término latino para «gran superviviente».
No se diferencia mucho de los otros organismos que la rodean, pero M. superstes posee una ventaja muy importante: ha desarrollado un mecanismo genético de supervivencia.
Quedan un sinfín de pasos evolutivos que dar en los miles de millones de años posteriores, cambios tan extremos que surgirán nuevas ramas de vida. Estos cambios, producto de mutaciones, injertos o reorganizaciones genéticas y de transferencias de genes entre distintas especies, crearán organismos con simetría bilateral, visión estereoscópica e incluso consciencia.
En comparación, este primer paso evolutivo parece, en principio, muy simple. Es un circuito. Un circuito genético.
El circuito comienza con el gen A, un cuidador que evita que las células se reproduzcan cuando las condiciones son duras. Esto es esencial, porque, en este primitivo planeta Tierra, las condiciones casi siempre son duras. El circuito también tiene un gen B, que codifica una proteína «silenciadora». Esta proteína aísla al gen A cuando las condiciones son las adecuadas para que la célula se copie a sí misma exclusivamente cuando tanto ella como sus vástagos puedan sobrevivir.
Los genes en sí mismos no son novedosos. Toda la vida del lago tiene esos dos genes. Pero lo que hace que M. superstes sea única es que el gen B silenciador ha mutado hasta conseguir una segunda función: ayudar a reparar el ADN. Cuando las células del ADN se rompen, la proteína silenciadora codificada por el gen B se aleja del gen A para ayudar a reparar el ADN, y eso activa el gen A. Esto para temporalmente el sexo y la actividad reproductora hasta que el ADN esté completamente reparado.
Tiene sentido, porque, mientras el ADN esté roto, el sexo y la reproducción serán las últimas actividades que desarrollará un organismo. En los organismos multicelulares futuros, por ejemplo, las células que fallan a la hora de detenerse mientras se repara el ADN pierden casi con total seguridad el material genético. Esto se debe a que, antes de la división celular, el ADN se retira de un solo punto de unión y arrastra a su vez el resto del ADN. Si la cadena se rompe, parte de un cromosoma puede perderse o duplicarse. En ese caso, es posible que las células mueran o que se multipliquen de forma descontrolada y ocasionen un tumor.
Puesto que ahora tiene un gen silenciador que también repara el ADN, M. superstes cuenta con una ventaja: se detiene cuando el ADN resulta dañado, pero después revive. Está superpreparada para sobrevivir.
Y eso es bueno, porque ahora llega otro ataque a la vida. Unos rayos cósmicos muy poderosos procedentes de una erupción solar lejana bañan la Tierra y hacen trizas el ADN de todos los microorganismos de los lagos secos. La gran mayoría de ellos sigue reproduciéndose como si no pasara nada, sin saber que sus genomas están rotos y que la reproducción acabará con ellos. Entre las células madre e hija se intercambia una cantidad desigual de ADN, lo que hace que ambas fallen. A la postre, los esfuerzos caen en saco roto y las células mueren sin dejar nada.
Excepto M. Superstes, claro está. Porque, mientras los rayos causan estragos, M. superstes se dispone a hacer algo inusual: gracias a que la proteína B se separa del gen A para ayudar a reparar el daño en el ADN, el gen A se activa y las células detienen casi toda la actividad para concentrar la limitada energía de la que disponen en la reparación del ADN dañado. Gracias a que le ha plantado cara al impulso ancestral e imperativo de reproducirse, M. superstes logra sobrevivir.
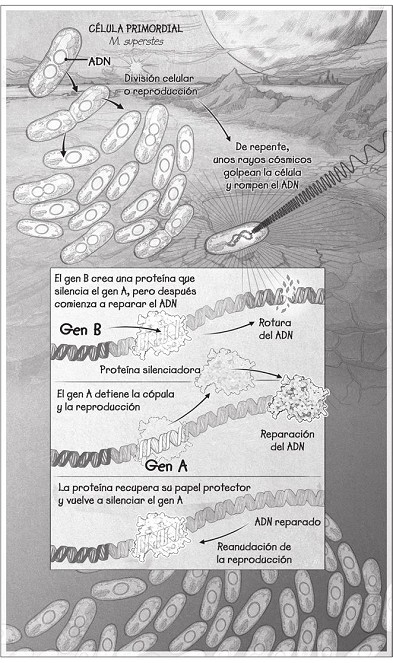
Cuando el último período de sequía llega a su fin y los lagos se llenan de nuevo de agua, M. superstes se despierta. Ahora sí puede reproducirse. Y lo hace una y otra vez. Se multiplica. Se traslada a nuevos biomas. Evoluciona. Crea generación tras generación de nuevos descendientes.
Son nuestros Adán y Eva.
Al igual que ocurre con ellos, tampoco sabemos si M. superstes llegó a existir. Pero las pruebas que he encontrado a lo largo de los veinticinco años que llevo investigando sugieren que todo ser vivo que nos rodea hoy en día es producto de este gran superviviente, o al menos de un organismo primitivo muy parecido a él. El registro fósil de nuestros genes demuestra con creces que todo ser vivo que habita en este planeta con nosotros posee este antiguo circuito genético de supervivencia, más o menos en su misma forma básica. Está presente en todas las plantas. En todos los hongos. En todos los animales.
Y en nosotros.
Mi teoría es que este circuito genético se ha conservado porque es una solución simple y elegante a los desafíos que presenta el mundo, a veces inhóspito y a veces generoso, con la que se asegura la supervivencia de los organismos que lo poseen. Es, en esencia, un kit de supervivencia primordial que desvía la energía a las zonas que más la necesitan y realiza las reparaciones precisas en esos momentos en los que el mundo se propone hacer estragos con el genoma, al mismo tiempo que asegura la reproducción en los momentos favorables.
Además, es tan simple y tan robusto que no solo aseguró la continuidad de la vida en el planeta, sino que también logró que el circuito genético de supervivencia pasara de padres a hijos, mutando y mejorando de forma gradual, lo que ayudó a que la vida siguiera existiendo durante miles de millones de años, sin importar lo que el universo nos echara encima y, en muchos casos, permitiendo que ciertas vidas individuales se prolongaran más de lo necesario.
El cuerpo humano, si bien dista mucho de ser perfecto y sigue en evolución, porta una versión avanzada de este circuito de supervivencia que le posibilita vivir durante muchas décadas a pesar de que haya pasado la edad de reproducirse. Aunque es interesante especular sobre el motivo por el que la longevidad aumentó en un primer momento (la necesidad de contar con unos abuelos que educaran a la tribu es una teoría interesante), dado el caos que existe a escala molecular, es asombroso que logremos sobrevivir treinta segundos, toda una hazaña que consigamos seguir viviendo después de la etapa reproductiva, y ya ni hablamos de llegar a los ochenta como algo habitual.
Pero eso es lo que hacemos. Y es algo maravilloso. Un milagro. Porque somos la progenie de un largo linaje de grandes supervivientes. Por tanto, nosotros también somos grandes supervivientes.
Sin embargo, también hay una desventaja, porque este circuito que portamos, el descendiente de toda una serie de mutaciones que sufrieron nuestros ancestros más lejanos, es el motivo de que envejezcamos.
Y sí, no me equivoco al expresarlo así. Es el único motivo.
TODO TIENE UN PORQUÉ
Si te horroriza la idea de que haya una causa concreta que provoca el envejecimiento, ten por seguro que no eres el único. Si nunca has reflexionado sobre el hecho de por qué envejecemos, te aseguro que también es normal. Hay muchos biólogos que tampoco han reflexionado mucho al respecto. Ni siquiera los gerontólogos, los médicos especializados en los problemas del envejecimiento, se preguntan por qué envejecemos. Se limitan a tratar las consecuencias.
Pero no se trata de una miopía que afecte tan solo al envejecimiento. Sin ir tan lejos, en los años sesenta, por ejemplo, la lucha contra el cáncer era una lucha contra sus síntomas. No había una explicación unificada para su aparición, de manera que los médicos extirpaban los tumores lo mejor que podían y dedicaban mucho tiempo a advertirles a sus pacientes de que fueran haciendo testamento. El cáncer, como la vida, era así. Porque eso es lo que decimos cuando no tenemos explicación para algo.
Pero después, en la década de los setenta, los biólogos moleculares Peter Vogt y Peter Duesberg descubrieron genes que causan cáncer cuando mutan. Estos genes, llamados «oncogenes», alteraron por completo el paradigma de la investigación sobre el cáncer. Los laboratorios farmacéuticos por fin tenían un objetivo al que disparar: las proteínas inductoras de un tumor codificadas por ciertos genes como BRAF, HER2 y BCR-ABL. Al desarrollar medicamentos que bloqueaban específicamente las proteínas inductoras de tumores, por fin podíamos alejarnos de la radiación y de la quimioterapia más agresiva y atacar directamente la raíz genética de los tumores, sin tocar las células normales. Es evidente que desde entonces todavía no hemos curado todos los tipos de cáncer, pero ya no nos parece imposible lograrlo.
De hecho, muchos de los investigadores se muestran optimistas al respecto. Y esa esperanza también alentó la parte más memorable del discurso del presidente Barack Obama durante el Discurso sobre el Estado de la Unión de 2016.
«Por los seres queridos que hemos perdido, por los familiares que todavía podemos salvar, vamos a conseguir que Estados Unidos sea el país que cure el cáncer de una vez por todas», dijo Obama mientras se dirigía a la Cámara de Representantes, que pidió un esfuerzo nacional para vencer la enfermedad y anunció el comienzo de un programa llamado Cancer Moonshot. Cuando puso al frente de dicho programa al vicepresidente Joe Biden, que había perdido un año antes a su hijo Beau a causa de un cáncer, incluso algunos de los enemigos más acérrimos de los demócratas tuvieron problemas para contener las lágrimas.
Durante los días y las semanas posteriores al discurso, muchos investigadores señalaron que se tardaría más de un año en encontrar la cura del cáncer, que era el tiempo que les quedaba a Obama y Biden en el gobierno. Sin embargo, fueron muy pocos los que dijeron que era imposible. Y eso se debe a que, en el corto espacio de tiempo que suponen un par de décadas, hemos cambiado por completo nuestra manera de enfrentarnos al cáncer. Ya no lo vemos como algo inevitable que forma parte de la condición humana.
Uno de los logros más prometedores de la pasada década fue la terapia de puntos de control inmunitarios o, simplemente, inmunoterapia. Los linfocitos T patrullan constantemente nuestro cuerpo en busca de células cancerosas a las que identificar y destruir antes de que puedan multiplicarse y formar un tumor. De no ser por esos linfocitos T, todos desarrollaríamos cáncer a partir de los veinte años. Pero las células cancerosas generan distintos modos de evitar ser detectadas por los linfocitos T para poder multiplicarse alegremente. Las inmunoterapias más recientes y efectivas atacan a las proteínas que se encuentran en la superficie de las células cancerosas. Es como quitarles a dichas células la capa de invisibilidad para que los linfocitos T las identifiquen y las destruyan. Aunque en la actualidad solo se beneficia de la inmunoterapia algo menos del 10 por ciento de los pacientes, esa cifra debería incrementarse gracias a los cientos de ensayos clínicos que se están llevando a cabo.
Seguimos rebelándonos contra una enfermedad que antes aceptábamos como algo del destino e invertimos miles de millones de dólares cada año en investigación, pero el esfuerzo da sus frutos. Las tasas de supervivencia de algunos tipos de cáncer que eran letales en el pasado han aumentado de forma significativa. Gracias a una combinación de inhibidores de BRAF e inmunoterapia, la supervivencia al melanoma maligno con metástasis cerebral, uno de los tipos de cáncer más letales que existen, ha aumentado hasta un 91 por ciento desde 2011. Entre 1991 y 2016, las muertes totales provocadas por el cáncer en Estados Unidos disminuyeron en un 27 por ciento y lo siguen haciendo. Es una victoria que se cuantifica en millones de vidas.
La investigación sobre el envejecimiento está hoy en día en un punto similar a la del cáncer en los años sesenta. Contamos con una buena base de conocimiento acerca del aspecto que presenta el proceso y sobre lo que nos provoca, y existe un acuerdo incipiente sobre lo que lo origina y lo que lo frena. Todo indica que el envejecimiento no va a ser algo difícil de tratar y que es mucho más sencillo que curar el cáncer.
Hasta la segunda mitad del siglo XX se aceptaba mayoritariamente que los organismos envejecían y morían «por el bien de la especie», una idea que se remonta a los tiempos de Aristóteles, si no más allá. Esta idea parece demasiado intuitiva. Es la explicación que muchas personas ofrecen en las fiestas. Pero no puede ser más desacertada. No morimos para dejarle sitio a la siguiente generación.
En los años cincuenta del siglo pasado, el concepto de «selección de grupo» en la teoría de la evolución se estaba pasando de moda, lo que alentó a tres biólogos evolutivos, J. B. S. Haldane, Peter B. Medawar y George C. Williams, a proponer algunas ideas importantes sobre por qué envejecemos. En lo referente a la longevidad, acordaron, los individuos solo se preocupan de sí mismos. Motivados por sus genes egoístas, siguen adelante y tratan de procrear todo lo que pueden y lo más rápido posible, siempre y cuando eso no los mate. (Sin embargo, en algunos casos el empeño es desmesurado, como mi bisabuelo, Miklós Vitéz, un guionista húngaro, le demostró a su flamante esposa, cuarenta y cinco años más joven que él, en su noche de bodas.)
Si nuestros genes no quieren morir nunca, ¿por qué no vivimos eternamente? El trío de biólogos argumentó que experimentamos un proceso de envejecimiento porque las fuerzas de la selección natural que requieren la construcción de un cuerpo robusto son potentes a los dieciocho años, pero sufren un rápido declive a partir de los cuarenta, ya que para entonces es muy posible que hayamos replicado nuestros genes egoístas lo suficiente como para asegurar su supervivencia. Y, al final, las fuerzas de la selección natural llegan al cero. Los genes siguen adelante. Nosotros, no.
Medawar, que tendía a la verborrea, expuso una teoría detallada llamada «hipótesis de la pleiotropía antagonista». Resumiendo, la hipótesis expone que los genes que nos ayudan a reproducirnos cuando somos jóvenes no solo dejan de ser útiles cuando envejecemos, sino que también nos perjudican.
Veinte años después, Thomas Kirkwood, de la Universidad de Newcastle, respondió la pregunta de por qué envejecemos basándose en los recursos de los que dispone un organismo. Su teoría se conoce como «hipótesis del soma desechable» y se basa en el hecho de que los recursos de los que disponen las especies siempre son limitados: la energía, los nutrientes y el agua. Por tanto, evolucionan hasta un punto situado entre dos estilos de vida muy distintos: reprodúcete pronto y muere joven; o reprodúcete despacio y mantén tu «soma», es decir, el cuerpo. Kirkwood afirmaba que los organismos no pueden reproducirse rápido y mantener al mismo tiempo un cuerpo sano y robusto. Simplemente no hay energía suficiente para las dos cosas. Dicho de otro modo, en la historia de la vida, cualquier criatura con una mutación que la haga vivir rápido e intentar morir pronto agota rápidamente sus recursos y, por tanto, queda eliminada del patrimonio genético.
La teoría de Kirkwood queda mejor ilustrada con algún ejemplo ficticio, pero potencialmente real. Imagina que eres un pequeño roedor que tiene muchas papeletas de acabar siendo pasto de un ave rapaz. Debido a eso, necesitas traspasar tu material genético lo antes posible, tal y como hicieron tus padres y tus abuelos. Las combinaciones genéticas que te habrían provisto de un cuerpo más duradero no se han producido en tu especie, porque tus ancestros posiblemente no lograron escapar de los depredadores a la larga, y tú tampoco lo harás.
Pero ahora imagina, en cambio, que eres un ave rapaz situada en lo más alto de la cadena alimentaria. Gracias a eso, tus genes (bueno, más bien los genes de tus ancestros) se beneficiaron con la creación de un cuerpo robusto y perdurable que puede procrear durante décadas. Pero, a cambio, solo podían criar a un par de polluelos al año.
La hipótesis de Kirkwood explica por qué un ratón vive tres años mientras que algunas aves pueden vivir hasta cien. También explica de forma elegante por qué el lagarto camaleón americano, o Anolis carolinensis, aumenta su longevidad a un ritmo sorprendente después de haber llegado hace unas décadas a una remota isla de Japón donde no hay depredadores.
Estas teorías encajan con los estudios y se aceptan de forma generalizada. Los individuos no viven eternamente porque la selección natural no selecciona la inmortalidad en un mundo donde el patrón corporal existente funciona a la perfección a la hora de transmitir los genes egoístas de un cuerpo. Y, puesto que todas las especies cuentan con recursos limitados, han evolucionado para concentrar su energía bien en la reproducción, o bien en la longevidad, pero no en ambas. Eso era cierto en el caso de M. superstes y lo sigue siendo para todas las especies que han poblado este planeta.
Salvo para una, claro está: el Homo sapiens.
Tras sacarle partido a su cerebro relativamente grande y a una civilización próspera para ganar con la mano perdedora que le ha repartido la evolución (extremidades débiles, sensibilidad al frío, olfato pobre y ojos que solo ven a la luz del día y en el espectro visible), esta especie tan inusual sigue innovando. Ya se ha abastecido con abundante comida, nutrientes y agua al tiempo que ha disminuido las muertes por depredadores, condiciones adversas, enfermedades infeccionas y guerras. Todas esas causas fueron en otra época limitaciones para que evolucionara hasta aumentar su esperanza de vida. Con ellas fuera del tablero, unos cuantos millones de años más de evolución pueden conseguir duplicar su longevidad y acercarla a la esperanza de vida de otras especies dominantes. Pero no hace falta esperar tanto, ni por asomo. Porque esta especie está trabajando de forma diligente para crear medicamentos y tecnologías que le ofrezcan la robustez de una especie que ha evolucionado durante años, consiguiendo de verdad lo que la evolución no le pudo proporcionar.
SITUACIÓN DE CRISIS
Wilbur y Orville Wright no podrían haber construido una máquina voladora sin tener conocimiento sobre las corrientes de aire y la presión negativa, o sin crear un túnel de viento. Ni Estados Unidos podría haber enviado hombres a la Luna sin entender de metalurgia, la combustión líquida y los ordenadores, o sin tener cierta dosis de confianza de que la Luna no está hecha de queso.
De la misma manera, si queremos progresar de verdad en los esfuerzos para aliviar el sufrimiento que conlleva el envejecimiento, se necesita una explicación unánime de por qué envejecemos, no solo a nivel evolutivo, sino también fundamental.
Pero explicar el envejecimiento a nivel fundamental no es una tarea fácil. Tendría que satisfacer todas las leyes conocidas de la física, así como las reglas químicas, y ser coherente con cientos de años de estudios biológicos. Tendría que cubrir el casi desconocido mundo que existe entre el tamaño de una molécula y el de un grano de arena, y debería explicar simultáneamente las formas de vida más simples y las más complejas que han existido.
Por tanto, no debería ser una sorpresa que nunca haya habido una teoría unánime sobre el envejecimiento, al menos que se haya sostenido, y no por falta de intentos.
Una hipótesis, propuesta de forma independiente por Peter Medawar y Leo Szilard, fue que el envejecimiento lo ocasionaban el daño en el ADN y la pérdida resultante de información genética. A diferencia de Medawar, que siempre fue biólogo y que hizo carrera en la inmunología, además de ganar un Premio Nobel, Szilard llegó a la biología de modo indirecto. Este erudito e inventor nacido en Budapest vivía de manera nómada, sin trabajo ni dirección fijos, y prefería pasar el tiempo con aquellos colegas capaces de satisfacer su curiosidad sobre las grandes cuestiones a las que se enfrentaba la humanidad. En una primera época se dedicó a la física nuclear, en la que fue pionero, y colaboró en la creación del Proyecto Manhattan, que abrió la puerta a la guerra nuclear. Horrorizado por las incontables vidas segadas por culpa de su proyecto, enfocó su atribulada mente en el afán de alargar la vida lo máximo posible.
La idea de que la acumulación de mutaciones origina el envejecimiento causó furor entre los científicos de los años cincuenta y sesenta, en una época en la que los efectos de la radiación en el ADN humano siempre estaban presentes en la mente de todo el mundo. Pero, aunque sabemos con certeza que la radiación es capaz de crear todo tipo de problemas en nuestras células, solo causa un subgrupo de las marcas y los síntomas que observamos durante el envejecimiento, así que no sirve como teoría universal.
En 1963, el biólogo británico Leslie Orgel aportó su grano de arena con su «teoría del error catastrófico», que postula que los errores producidos durante el proceso de copia del ADN conllevan mutaciones en los genes, incluidas las proteínas necesarias para copiar dicho ADN. El proceso, por tanto, interrumpe cada vez más esos mismos procesos, multiplicándose a partir de sí mismos hasta que el genoma humano se copia de manera incorrecta y desaparece.
Más o menos durante la época en la que Szilard estaba concentrado en la radiación, Denham Harman, un químico que trabajaba para Shell Oil, también estaba pensando en el átomo, pero de forma distinta. Después de graduarse en Medicina por la Universidad de Stanford, propuso la «teoría del envejecimiento de los radicales libres», que culpa del envejecimiento a los electrones sin pareja que pululan en el interior de las células y los acusa de dañar el ADN mediante la oxidación, sobre todo a nivel mitocondrial, porque allí es donde se generan más radicales libres. Harman se pasó gran parte de su vida probando su teoría.
Tuve el placer de conocer a la familia Harman en el año 2013. Su esposa me dijo que el profesor Harman tomaba dosis altas de ácido alfa lipoico para neutralizar los radicales libres. Teniendo en cuenta que trabajó de modo incansable en su investigación hasta pasados los noventa años, supongo que, al menos, no le hizo daño.
Durante las décadas de 1970 y 1980, Harman y cientos de investigadores más trataron de comprobar si los antioxidantes alargaban la esperanza de vida de los animales. Los resultados en general fueron desalentadores. Aunque Harman tuvo cierto éxito aumentando la longevidad de los roedores, por ejemplo, con el butilhidroxitolueno, un aditivo alimentario, ninguno demostró un aumento en su esperanza de vida total. Dicho de otro modo, un grupo de animales de laboratorio logró vivir unas semanas más de media, pero ninguno de los animales logró superar récord alguno de longevidad. Desde entonces, la ciencia ha demostrado que los efectos positivos para la salud que se pueden conseguir gracias a una dieta rica en antioxidantes se deben más bien a la estimulación que experimentan las defensas naturales del cuerpo contra el envejecimiento, entre las que se incluyen una mayor producción de las enzimas que neutralizan los radicales libres, pero no como resultado del antioxidante por sí mismo.
Si es difícil abandonar las costumbres, el premio a la perseverancia se lo llevan los radicales libres. La teoría fue desbancada hace más de diez años por otros científicos de mi campo; sin embargo, se ha perpetuado a lo largo y ancho del mundo gracias a los vendedores de pastillas y bebidas, una industria que mueve más de tres mil millones de dólares en todo el mundo. Con toda la publicidad que hay, no es sorprendente que más del 60 por ciento de los consumidores estadounidenses siga buscando alimentos y bebidas ricas en antioxidantes.
Es cierto que los radicales libres causan mutaciones, por supuesto que lo hacen. Y se pueden encontrar mutaciones en abundancia, sobre todo en células expuestas al mundo exterior y en el genoma mitocondrial de las personas de más edad. El declive mitocondrial es ciertamente una de las marcas distintivas del envejecimiento y puede conllevar un mal funcionamiento del órgano en sí. Pero la existencia de mutaciones aisladas, en particular las del genoma nuclear, choca con las evidencias cada vez más abundantes que demuestran lo contrario.
Arlan Richardson y Holly Van Remmen pasaron más de diez años en la Universidad de Texas, en San Antonio, comprobando si el aumento del daño o las mutaciones provocadas por los radicales libres en ratones causaba el envejecimiento; pero no. En mi laboratorio y en muchos otros ha sido sorprendentemente fácil restaurar la función de la mitocondria en ratones viejos, lo que indica que una buena parte del envejecimiento tampoco se debe a las mutaciones en el ADN mitocondrial, al menos no hasta una edad muy avanzada.
Aunque el debate sobre el papel que juegan las mutaciones del ADN nuclear continúa, hay un dato que contradice todas estas teorías, un dato difícil de refutar.
Por irónico que parezca, fue Szilard, en 1960, quien inició el fallecimiento de su propia teoría al descubrir cómo clonar una célula humana. La clonación nos ofrece la respuesta a si las mutaciones pueden o no causar el envejecimiento. Si las células viejas han perdido ciertamente información genética crucial y eso es lo que provoca el envejecimiento, no deberíamos poder clonar individuos jóvenes de individuos viejos. Los clones deberían ser viejos también.
Es falso que los clones envejecen de forma prematura. Es una idea que han perpetuado los medios de comunicación y que incluso se repite en la página web de los Institutos Nacionales de la Salud (NIH, por sus siglas en inglés). Sí, es cierto que Dolly, la primera oveja clonada, creada por Ian Wilmut y Keith Campbell en el Instituto Roslin de la Universidad de Edimburgo, vivió la mitad de lo que suele vivir una oveja normal y murió a causa de una enfermedad pulmonar progresiva. Sin embargo, un análisis exhaustivo de sus tejidos demostró que no había signos de envejecimiento prematuro. Mientras tanto, en la lista de animales que han sido clonados y que han vivido una vida normal y saludable se incluyen cabras, ovejas, ratones y vacas.
Debido a que la transferencia nuclear funciona en la clonación, podemos afirmar con bastante seguridad que el envejecimiento no lo causan las mutaciones en el ADN nuclear. Sí, es posible que ciertas células del cuerpo no muten y que estas sean las que acaben creando clones exitosos, pero parece poco probable. La explicación más sencilla es que los animales viejos conservan toda la información genética necesaria para generar un animal joven y sano, y que las mutaciones no son la principal causa del envejecimiento.
No es motivo de deshonor para todos esos brillantes investigadores que se haya demostrado que sus teorías son inciertas. Eso sucede con la mayoría de las investigaciones científicas y tal vez con todas, en realidad. En La estructura de las revoluciones científicas, Thomas Kuhn señaló que un descubrimiento científico nunca está completo; pasa por unas fases de evolución predecibles. Cuando una teoría tiene éxito a la hora de explicar un fenómeno natural inexplicable hasta entonces, se convierte en una herramienta que los científicos pueden usar para descubrir mucho más.
Sin embargo y de forma inevitable, esos nuevos descubrimientos llevan a plantearse nuevas incógnitas que la teoría no acaba de responder del todo, las cuales conllevan otras incógnitas. En poco tiempo, el modelo sufre una crisis y empieza a ir a la deriva mientras los científicos tratan de ajustarlo, lo menos posible, para dar respuesta a lo que no se puede explicar.
La situación de crisis es un momento fascinante en el ámbito científico, pero no es recomendable para los débiles de corazón, porque las dudas sobre los descubrimientos de las generaciones anteriores comienzan a aumentar entre las protestas de la vieja guardia. Pero el caos acaba siendo reemplazado por un cambio en el paradigma, un cambio tras el cual emerge un nuevo modelo consensuado capaz de explicar más que el anterior.
Eso fue lo que sucedió hace unos diez años, cuando las ideas de los científicos que lideraban las investigaciones sobre el envejecimiento empezaron a conformar un nuevo modelo; uno que sugería que el motivo por el que tanta gente brillante había fracasado a la hora de identificar una sola razón que explicara el envejecimiento era que no existía tal cosa.
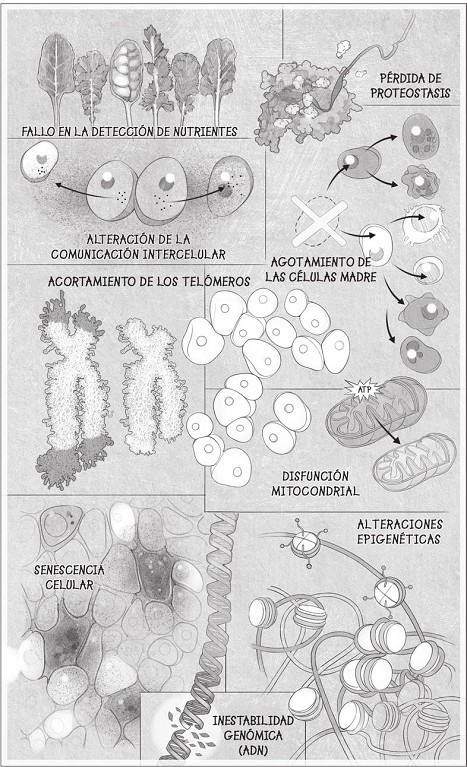
Según esta teoría tan distinta, el envejecimiento y las enfermedades que conlleva son resultado de las múltiples «marcas distintivas» del envejecimiento:
• Inestabilidad del genoma provocada por el daño en el ADN.
• Acortamiento de los telómeros, los extremos de los cromosomas.
• Alteraciones en el epigenoma que controla los genes que actúan y los que no.
• Pérdida de proteostasis, o buen mantenimiento de las proteínas.
• Fallo en la detección de nutrientes, ocasionado por cambios metabólicos.
• Disfunción mitocondrial.
• Acumulación de células senescentes que inflaman las células sanas.
• Agotamiento de las células madre.
• Alteración en la comunicación intercelular y en la producción de
moléculas inflamatorias.
Los investigadores aceptaron con cautela la nueva idea: si se tratan dichas marcas distintivas, se puede ralentizar el envejecimiento; si se ralentiza el envejecimiento, se pueden prevenir las enfermedades; y si se previenen las enfermedades, se puede retrasar la muerte.
Tomemos como ejemplo las células madre, que tienen el potencial de convertirse en cualquier otro tipo de célula. Si logramos evitar que estas células no diferenciadas se cansen, podrán generar de forma continua las células diferenciadas necesarias para reparar los tejidos dañados y luchar contra todo tipo de enfermedades.
Entretanto, estamos mejorando el porcentaje de aceptación en los trasplantes de médula ósea, la terapia más habitual con células madre, y usamos estas para tratar la artritis en las articulaciones, la diabetes de tipo 1, la pérdida de visión y algunas enfermedades degenerativas, como el alzhéimer y el párkinson. Estas terapias con células madre añaden años de vida a los pacientes.
Otro ejemplo: las células senescentes, que han perdido la capacidad de dividirse pero que se niegan a morir y siguen emitiendo señales de pánico que inflaman las células que las rodean. Si podemos erradicarlas o evitar que se acumulen en primer lugar, podremos mantener sanos nuestros tejidos durante más tiempo.
Lo mismo se puede decir sobre la lucha contra el acortamiento de los telómeros, la pérdida de la proteostasis o el resto de las marcas distintivas. Cada una de ellas se puede combatir de forma individual, poco a poco, de maneras que nos ayuden a aumentar la esperanza de vida humana.
Durante el último cuarto de siglo, los investigadores han ido concentrando sus esfuerzos en combatir estas marcas distintivas, tras alcanzarse el amplio consenso de que esa sería la mejor manera de aliviar el dolor y el sufrimiento de las personas que están envejeciendo.
Hay pocas dudas de que la lista de dichas marcas, aunque incompleta, constituye los cimientos de un manual táctico importante para disfrutar de una vida más larga y sana. Los tratamientos que ralenticen cualquiera de esas marcas distintivas pueden añadir unos cuantos años de bienestar a nuestras vidas. Si pudiéramos tratarlas todas, la recompensa sería un enorme aumento en la media de la esperanza de vida.
¿Y cómo expandimos el límite? Tratar estas marcas distintivas tal vez no sea suficiente para lograrlo.
Sin embargo, la ciencia avanza muy rápido, más que nunca, gracias a la acumulación de conocimiento a lo largo de muchos siglos; a robots que analizan miles de medicamentos potenciales todos los días; a máquinas secuenciales que leen millones de genes al día, y a poderosos ordenadores que procesan billones de bytes de datos a velocidades que eran inimaginables hace tan solo una década. Las teorías sobre el envejecimiento, que se han analizado muy lentamente durante años, ahora resultan más fáciles de comprobar y de refutar.
Aunque todavía está en pañales, ya se está produciendo un nuevo cambio de pensamiento. Nos encontramos de nuevo en un período de caos: todavía estamos seguros de que las marcas distintivas son indicadores precisos del envejecimiento y su miríada de síntomas, pero somos incapaces de explicar por qué aparecen en primer lugar dichas marcas distintivas.
Ha llegado la hora de dar respuesta a esta vieja incógnita.
Ahora bien, encontrar una explicación universal, sobre todo si se trata de algo tan complicado como el envejecimiento, no sucede de un día para otro. Cualquier teoría que intente explicar el envejecimiento no solo debe someterse al escrutinio científico, sino también proporcionar una explicación racional para todos los pilares del envejecimiento. Una hipótesis universal que parezca ofrecer un motivo para la senescencia celular, pero no para el agotamiento de las células madre, por ejemplo, no explicaría nada.
Sin embargo, creo que esa respuesta existe: una causa de envejecimiento que está por encima de todas las marcas distintivas. Sí, una razón única que explica por qué envejecemos.
El envejecimiento es, simplemente, una pérdida de información.
Tal vez caigas en la cuenta de que esa pérdida era una parte importante de las ideas que expusieron de forma independiente Szilard y Medawar, pero no era la correcta, porque sus teorías se centraban en la pérdida de información genética.
Hay dos tipos de información en biología y están codificados de formas muy distintas. El primer tipo, el que comprendían mis estimados predecesores, es digital. La información digital, como ya sabrás, se basa en un conjunto finito de valores posibles; en este ejemplo, no en base 2 o binario, representado solo por 0 y 1, sino de base 4 o cuaternario, representado por la adenina, la tiamina, la guanina y la citosina, los nucleótidos A, T, G y C del ADN.
Como el ADN es digital, es una forma fiable de almacenar y copiar información. De hecho, puede copiarse una y otra vez con una tremenda precisión, que no difiere en principio de la información digital almacenada en la memoria de un ordenador o en un DVD.
El ADN también es robusto. Durante mi primera época en el laboratorio, me sorprendió comprobar que esta «molécula de la vida» era capaz de sobrevivir durante horas en agua hirviendo y me emocioné al descubrir que podía recuperarse de fósiles de neandertales de al menos cuarenta mil años de antigüedad. Las ventajas del almacenamiento digital explican por qué las cadenas de ácidos nucleicos han seguido siendo el sistema de almacenaje molecular durante los últimos cuatro mil millones de años.
El otro tipo de información que posee nuestro cuerpo es analógico.
No oímos muchas cosas sobre la información analógica del cuerpo. Por una parte, porque es nueva para la ciencia y, por otra, porque rara vez se describe en términos de información, aun cuando así fue como se describió por primera vez cuando los genetistas descubrieron efectos no genéticos extraños en las plantas que estaban cultivando.
Hoy en día, la información analógica se conoce comúnmente como «epigenoma» y comprende los rasgos que son hereditarios, pero que no se transmiten a través de los genes.
El término «epigenética» lo acuñó en 1942 el británico Conrad H. Waddington, un biólogo del desarrollo, mientras trabajaba en la Universidad de Cambridge. En la pasada década, el significado de la palabra se ha expandido hacia otras áreas de la biología que tienen menos que ver con la herencia (entre ellas están el desarrollo embrionario, las redes de regulación genética y las modificaciones químicas de las proteínas que compactan el ADN), para disgusto de los genetistas ortodoxos de mi departamento en la Escuela de Medicina de Harvard.
De la misma manera que la información genética se almacena como ADN, la información epigenética se almacena en una estructura llamada «cromatina». El ADN no se mueve de forma desorganizada en el interior de la célula, sino que se encuentra firmemente compactado alrededor de pequeñas bolas de proteína llamadas «histonas». Estas bolitas se organizan enrollándose, como cuando enrollas la manguera del jardín. Si usáramos los extremos de un cromosoma para jugar al tira y afloja, acabaríamos con una cadena de ADN de casi dos metros de largo con miles de histonas unidas. Si de alguna manera pudiéramos conectar un extremo de la cadena de ADN a un enchufe y lograr que las histonas se encendieran y apagaran, podríamos usarlas como guirnaldas de luces navideñas.
En las especies simples, como la antigua M. superstes y los hongos hoy en día, el almacenamiento y la transferencia de información epigenética es importante para la supervivencia. Para las formas de vida complejas es esencial. Y por formas de vida complejas me refiero a cualquiera que conste de más de un par de células: mohos mucilaginosos, medusas, gusanos, moscas de la fruta y, por supuesto, los mamíferos, como nosotros. La información epigenética es la que organiza el ensamblaje de un recién nacido humano formado por veintiséis mil millones de células creadas a partir de un óvulo fecundado, así como lo que permite que las células genéticamente idénticas de nuestro cuerpo asuman miles de modalidades diferentes.
Si el genoma fuera un ordenador, el epigenoma sería el software. Da instrucciones a las células recién divididas sobre qué tipo de células deberían ser y lo que deberían seguir siendo, a veces durante décadas, como en el caso de las neuronas cerebrales individuales y ciertas células inmunitarias.
Por eso una neurona no se comporta de repente como una célula epitelial y por eso una célula del riñón dividida no da lugar a dos células de hígado. Sin la información epigenética, las células perderían rápidamente su identidad, y también las células nuevas. Si eso sucediera, los tejidos y los órganos dejarían de funcionar poco a poco, hasta fallar por completo.
En las cálidas charcas de la Tierra primigenia, un sistema químico digital era la mejor manera de almacenar la información genética a largo plazo. Pero también se necesitaba el almacenamiento de información para registrar y reaccionar a las condiciones ambientales, y eso se almacenaba mejor en formato analógico. Los datos analógicos son mejores para realizar este trabajo, porque se pueden cambiar con relativa facilidad cuando lo exija el entorno interno o externo de la célula, y pueden almacenar un número casi ilimitado de valores posibles, incluso en respuesta a condiciones que no se hayan dado nunca.
Ese número ilimitado de valores es el motivo por el que muchos audiófilos siguen prefiriendo los sonidos de los sistemas de almacenamiento analógicos. Pero, aunque los sistemas analógicos tengan sus ventajas, cuentan con una desventaja importante. De hecho, es el motivo de que hayamos cambiado lo analógico por lo digital. A diferencia de la información digital, la información analógica se degrada con el paso del tiempo; acaba siendo víctima de las fuerzas conspiradoras de los campos magnéticos, la gravedad, la radiación cósmica y el oxígeno. Y lo peor de todo es que se pierde información cuando se copia.
Nadie se sintió tan perturbado por el problema de la pérdida de información como Claude Shannon, un ingeniero eléctrico del Instituto Tecnológico de Massachusetts (MIT) de Boston. Después de la Segunda Guerra Mundial, Shannon sabía por experiencia que la existencia de «ruido» en una transmisión analógica de radio podía costarle la vida a mucha gente. Después de la guerra, escribió un exhaustivo artículo científico titulado «Teoría matemática de la comunicación», en el que ahondaba en la manera de preservar la información y que muchos consideraron los cimientos de la teoría de la información. Si existe un artículo científico que nos propulsara hacia el mundo digital sin cables en el que vivimos hoy en día, es este.
La verdadera intención de Shannon, por supuesto, era mejorar la fuerza de la electrónica y de la comunicación por radio entre dos puntos. Su trabajo demostró a la postre que puede ser mucho más importante que eso, porque creo que sus descubrimientos sobre conservación y restauración de la información se pueden aplicar al envejecimiento.
No te desilusiones cuando afirmo que somos el equivalente biológico de un viejo reproductor de DVD. En realidad, eso es una buena noticia. Si Szilard hubiera tenido razón al decir que las mutaciones ocasionaban el envejecimiento, no podríamos tratarlo de forma sencilla, porque, cuando la información se pierde sin que se haya hecho una copia previa, se pierde para siempre. Pregúntale a cualquiera que intente reproducir o restaurar el contenido de un DVD que tenga el borde roto: lo perdido perdido está.
Sin embargo, sí podemos recuperar información de un DVD rayado. Y, si estoy en lo cierto, ese mismo proceso es el que se aplicará para curar el envejecimiento.
Tal y como demostró de forma tan maravillosa la clonación, nuestras células retienen la información digital de la juventud incluso cuando somos viejos. Para ser jóvenes de nuevo, solo necesitamos encontrar un pulimento que quite los rayones.
Y creo que es posible hacerlo.
CADA COSA A SU TIEMPO
La teoría del envejecimiento por pérdida de información comienza con el circuito de supervivencia primigenio que heredamos de nuestros ancestros remotos.
A lo largo del tiempo, como es de esperar, el circuito ha evolucionado. Los mamíferos, por ejemplo, no solo tienen un par de genes que crean un circuito de supervivencia como aquellos primeros que aparecieron en M. superstes. Los científicos han descubierto más de veinticuatro en nuestro genoma. Casi todos mis colegas los llaman «genes de la longevidad», porque han demostrado poseer la habilidad de extender tanto la media de esperanza de vida como la longevidad en muchos organismos. Sin embargo, estos genes no solo alargan la vida, también hacen que sea más sana, de ahí que asimismo puedan calificarse como «genes de la vitalidad».
Juntos, estos genes forman una red de vigilancia en nuestro cuerpo. Se comunican entre ellos mediante las células y también se comunican con los órganos, liberando proteínas y sustancias químicas al torrente sanguíneo; supervisan y responden a lo que comemos, a la cantidad de ejercicio físico que hacemos y a la hora del día que sea; nos alertan de que debemos parar cuando la cosa se pone fea y nos dicen que vayamos más rápido y nos reproduzcamos con rapidez cuando las cosas van bien.
Y ahora que sabemos que esos genes existen y lo que hacen muchos de ellos, los descubrimientos científicos nos ofrecen la oportunidad de explorarlos y explotarlos, de imaginar su potencial, de conseguir que trabajen para nosotros de distintas maneras. Podemos interpretarlos, analizarlos de arriba abajo e incluso cambiarlos por completo utilizando moléculas naturales y nuevas, tecnología simple y compleja, conocimiento antiguo y novedoso.
Los genes de la longevidad con los que yo trabajo se llaman «sirtuinas», llamadas así por el gen SIR2 de la levadura, el primero que se descubrió. Los mamíferos cuentan con siete sirtuinas, de la SIRT1 a la SIRT7, y casi todas las células del cuerpo las tienen. Cuando empecé a investigar, las sirtuinas no estaban en el radar científico, pero hoy en día esta familia de genes se encuentra en el centro de todas las investigaciones científicas y farmacológicas.
Las sirtuinas, que son descendientes del gen B de M. superstes, son las enzimas desacetilasas de histona y de otras proteínas, que cambian la expresión genética y regulan la actividad de los genes, silenciándolos o activándolos cuando es necesario. Estos importantes reguladores epigenéticos se encuentran en lo más alto de la cadena de los sistemas de control celular y se encargan de controlar nuestra reproducción, así como de la reparación del ADN. Después de unos cuantos miles de millones de años de progreso desde los días de la levadura, han evolucionado para controlar nuestra salud, nuestro estado físico y nuestra propia supervivencia. También han evolucionado para depender de una molécula llamada «dinucleótido de nicotinamida y adenina» (NAD, por sus siglas en inglés). Tal como veremos más adelante, se cree que la pérdida de NAD cuando envejecemos, y el consecuente declive en la actividad de las sirtuinas, es el motivo principal de que nuestro cuerpo desarrolle enfermedades cuando envejecemos, pero no cuando somos jóvenes.
Las sirtuinas, que intercambian la reparación por la reproducción, le ordenan a nuestro cuerpo que se «detenga» en momentos de estrés y nos protegen de las enfermedades más importantes de la vejez: la diabetes y las enfermedades cardiovasculares, la enfermedad de Alzheimer y la osteoporosis, e incluso el cáncer. Silencian las inflamaciones hiperactivas y crónicas que acarrean enfermedades como la arterioesclerosis, los trastornos metabólicos, la colitis ulcerosa, la artritis y el asma. Previenen la muerte celular y estimulan la mitocondria, las pilas de la célula. Combaten la atrofia muscular, la osteoporosis y la degeneración macular. En estudios realizados con ratones, la activación de las sirtuinas puede mejorar la reparación del ADN, estimular la memoria, aumentar la resistencia física y ayudar a que los ratones no engorden coman lo que coman. Y todo esto no son suposiciones disparatadas. Los científicos lo han proclamado en distintos trabajos de investigación contrastados y publicados en revistas como Nature, Cell o Science.
Y en gran parte porque todo esto lo hacen basándose en un programa muy simple, el maravilloso gen B del circuito de su-pervivencia; está demostrando ser más sensible a la manipulación que muchos otros genes de la longevidad. Tal parece que son la primera ficha de dominó en la grandiosa máquina de Rube Goldberg que es la vida, la clave para entender cómo se protege a sí mismo nuestro material genético en épocas de adversidad, permitiendo que la vida persista y prospere durante miles de años.
Las sirtuinas no son los únicos genes de la longevidad. Hay otros dos grupos de genes que se han estudiado en profundidad y que realizan las mismas tareas, y que también han demostrado ser sensibles a la manipulación con el fin de ayudar a conseguir una vida más larga y sana.
Uno de ellos es la diana de rapamicina o TOR, una familia de proteínas que regula el crecimiento y el metabolismo. Al igual que las sirtuinas, los científicos han descubierto TOR (llamada mTOR en los mamíferos, por sus siglas en inglés) en todos los organismos en los que la han buscado. Al igual que sucede con las sirtuinas, la actividad de mTOR está altamente regulada por los nutrientes. Y al igual que sucede con las sirtuinas, mTOR puede indicarles a las células estresadas que descansen y mejorar la supervivencia, pues estimulan ciertas actividades, como la reparación del ADN, la reducción de la inflamación causada por las células senescentes y la que tal vez sea su función más importante: la absorción de proteínas viejas.
Cuando todo va bien, TOR es una maestra del crecimiento celular. Percibe la cantidad de aminoácidos disponible y regula la creación de proteína según dicha cantidad. Sin embargo, cuando se inhibe, obliga a las células a descansar, a dividirse menos y a reutilizar componentes celulares viejos para mantener los niveles de energía y aumentar la supervivencia; es más o menos como ir a un chatarrero en busca de piezas para arreglar un coche viejo en vez de comprar uno nuevo. Es un proceso denominado «autofagia». Cuando nuestros ancestros fallaban a la hora de cazar un mamut lanudo y tenían que sobrevivir con magras raciones de proteínas, fue precisamente la inhibición de mTOR lo que los ayudó a conseguirlo.
El otro gen de la longevidad es una enzima controladora del metabolismo conocida como AMPK, que ha evolucionado para responder a niveles de energía bajos. También se ha conservado bastante bien en las distintas especies y, al igual que sucede con las sirtuinas y con mTOR, hemos aprendido mucho sobre cómo controlarla.
Estos sistemas de defensa se activan como respuesta al estrés biológico. Es evidente que hay ciertas circunstancias difíciles de superar; por ejemplo, si pisamos un caracol, adiós, muy buenas. Un trauma agudo o una infección incontrolable matarán a un organismo sin envejecerlo. A veces el estrés que se produce en el interior de una célula, como una multitud de roturas en el ADN, es demasiado para que se recupere. Aunque la célula sea capaz de reparar el daño del ADN a corto plazo sin dejar mutaciones, se produce una pérdida de información a nivel epigenético.
Y aquí viene lo importante: hay un sinfín de factores estresantes capaces de activar los genes de la longevidad sin dañar la célula, entre los que se incluyen algunos ejercicios, el ayuno intermitente, las dietas bajas en proteínas y la exposición al frío y al calor (hablaré más de esto en el capítulo 4). A esto se le llama «hormesis». Por regla general, la hormesis es buena para los organismos, sobre todo cuando se puede inducir sin producir daños a largo plazo. Cuando se produce la hormesis, todo funciona bien. Y, de hecho, funciona mejor que bien, porque ese pequeño nivel de estrés que sucede cuando los genes están activos hace que el resto del sistema descanse para mantenerse y sobrevivir un poco más. Ese es el comienzo de la longevidad.
Para complementar este método están las moléculas que imitan la hormesis. Hay fármacos en desarrollo y, al menos, dos medicamentos en el mercado capaces de activar las defensas del organismo sin provocar daño alguno. Es como gastarle una broma telefónica al Pentágono: se envía el Cuerpo de Ingenieros del Ejército, pero no hay guerra alguna. De esta manera, podemos imitar los beneficios del ejercicio y del ayuno intermitente con una simple pastilla (hablaré de esto en el capítulo 5).
Nuestra habilidad para controlar todos estos recursos genéticos va a transformar de forma sustancial la medicina y nuestro día a día. De hecho, va a cambiar la manera en la que definimos nuestra especie.
Y sí, soy consciente de lo que acabo de afirmar. Así que permíteme explicarte el porqué.