Capítulo 6
Grandes pasos por delante
Cuando pensábamos en el envejecimiento, y rara vez lo hacíamos, solíamos creer que era algo muy complicado de cambiar, si acaso podíamos hacerlo.
Por supuesto, a lo largo de la mayor parte de la historia de la humanidad, hemos percibido el envejecimiento como el cambio de las estaciones; de hecho, el cambio de la primavera al verano, después al otoño y por último al invierno era una analogía habitual para describrir el paso de la infancia a la adolescencia, después a la edad adulta y por último a nuestros «años dorados». En una época más reciente, averiguamos que el envejecimiento era inexorable, pero que tal vez podríamos lidiar con algunas de las enfermedades que lo hacían un proceso muy poco apetecible. Un poco después, averiguamos que a lo mejor podríamos atacar cada una de sus marcas distintivas y tal vez tratar unos cuantos síntomas por separado. Incluso en ese momento, parecía un esfuerzo titánico. Pero ahí está el asunto: no lo es.
Una vez que reconoces que hay reguladores universales del envejecimiento en todo, desde la levadura hasta las ascárides, los ratones y los humanos…
Y una vez que entiendes que se pueden cambiar dichos reguladores con moléculas como NMN o unas cuantas horas de ejercicio intenso o algo menos de comida…
Y una vez que te das cuenta de que en realidad todo es una misma enfermedad…
… se ve todo más claro.
Es muy fácil lidiar con el envejecimiento.
Más fácil que con el cáncer.
Sé lo que parece esto: una locura.
Claro que también parecía una locura la idea de que existieran microorganismos antes de que un científico aficionado llamado Anton van Leeuwenhoek describiera por primera vez el mundo de «diminutos animales» que vio con su microscopio casero en 1671; durante los siguientes cientos de años, los médicos se rebelaron contra la idea de que tenían que lavarse las manos antes de una operación. Ahora las infecciones, una de las principales causas de la muerte de los pacientes tras una operación, se han convertido en lo que el personal hospitalario se esfuerza más por evitar en el quirófano. Solo con lavarse las manos antes de una operación se ha mejorado muchísimo el porcentaje de pacientes que sobreviven. Una vez comprendido cuál era el problema, la solución fue fácil.
Por favor, ¡que la solución era el jabón!
La idea de las vacunas también le habría parecido una locura a mucha gente antes de que el médico inglés Edward Jenner usara con éxito el fluido que extrajo de una ampolla de viruela para inocular a un niño de ocho años llamado James Phipps en lo que hoy habría sido un experimento sin ninguna ética, pero que en aquel momento abrió el camino hacia una nueva era en la medicina inmunológica. De hecho, la idea de darle al paciente un poquito de la enfermedad para evitar mucha cantidad de dicha enfermedad habría parecido una locura, incluso rayano en el homicidio, para muchas personas antes de que Jenner lo hiciera en 1796. Ahora sabemos que las vacunas son la intervención médica más eficaz de la historia de la humanidad para salvar y alargar la esperanza de vida. De modo que, de nuevo, una vez que comprendimos el problema, la solución fue muy sencilla.
El éxito de STAC, de los activadores de AMPK y de los inhibidores de mTOR es un poderoso indicador de que estamos trabajando en un área de nuestra biología que se encuentra por encima de cada una de las enfermedades más importantes asociadas al envejecimiento. El hecho de que se haya demostrado que estas moléculas alargan la esperanza de vida de prácticamente todos los organismos en los que los hemos probado supone otra prueba de que estamos acercándonos a un programa muy antiguo y poderoso para prolongar la vida.\1]
Sin embargo, hay otra diana farmacéutica que podría aumentar nuestra longevidad, solo un poquito por debajo de los procesos en los que creemos que influyen las moléculas de la longevidad, pero por encima de muchos de los síntomas del envejecimiento.
Tal vez recuerdes que una de las marcas distintivas del envejecimiento es la acumulación de células senescentes, que son células que han dejado de reproducirse de forma permanente.
Las células humanas jóvenes extraídas del cuerpo y cultivadas en una placa de Petri se dividen entre cuarenta y sesenta veces hasta que sus telómeros se acortan de forma crítica, un punto descubierto por el anatomista Leonard Hayflick que ahora conocemos como «límite de Hayflick». Aunque la enzima conocida como «telomerasa» puede alargar los telómeros (este descubrimiento les valió el Premio Nobel en 2009 a Elizabeth Blackburn, Carol Greider y Jack Szostak), se desactiva para protegernos del cáncer, salvo en las células madre. En 1997, fue un gran descubrimiento que, si ponías telomerasa en células epiteliales cultivadas, jamás envejecían.
El motivo de que las telomerasas cortas provoquen senescencia está casi resuelto. Una telomerasa muy corta perderá la compactación de las histonas y, al igual que un cordón de zapato que pierde su herrete, el ADN del extremo del cromosoma queda expuesto. La célula detecta el final del ADN y cree que está roto. Se pone manos a la obra para reparar el final del ADN, a veces fusionando dos finales de diferentes cromosomas, lo que conlleva la inestabilidad del hipergenoma, ya que los cromosomas se descomponen durante la división celular y se vuelven a fusionar una y otra vez, con el potencial de convertirse en cáncer.
La otra solución, más segura, para un telómero corto es desconectar la célula. Creo que esto sucede activando de forma permanente el circuito de supervivencia. El telómero expuesto, visto como una rotura de ADN, provoca factores epigenéticos como que las sirtuinas abandonen sus puestos de forma permanente en un intento por reparar el daño, pero no hay otro final de ADN al que ligarlo. Esto desactiva la replicación de células, algo parecido al modo en el que el ADN roto de la levadura vieja distrae a Sir2 de los genes de tipo sexual y desactiva la fertilidad.
Se sabe perfectamente que la activación de la respuesta al daño en el ADN y las alteraciones graves del epigenoma suceden en las células humanas senescentes, y cuando introducimos ruido epigenético en células ICE alcanzan la senescencia antes que las células sin tratar, de modo que tal vez esta idea tenga fundamento. Sospecho que la senescencia en células nerviosas y musculares, que no se dividen mucho o directamente no lo hacen, es el resultado del ruido epigenético que provoca que las células pierdan su identidad y dejen de funcionar. Esta respuesta otrora beneficiosa, que evolucionó para ayudar a las células a sobrevivir al daño en el ADN, tiene un lado oscuro: la célula en permanente estado de pánico envía señales a las células que la rodean, haciendo que entre estas también cunda el pánico.
Las células senescentes a menudo se conocen como «células zombis», porque, aunque deberían estar muertas, se niegan a morir. En la placa de Petri y en finísimas secciones de tejido, podemos tintar de azul células zombis porque producen una enzima rara llamada «betagalactosidasa», y cuando lo hacemos se iluminan de forma evidente. Cuanto más viejas sean las células, más azul veremos. Por ejemplo, una muestra de grasa blanca se ve blanca cuando tenemos veinte años, celeste en la mediana edad y azul marino en la vejez. Y da miedo, porque, cuando tenemos muchas de estas células senescentes en el cuerpo, es un signo evidente de que el envejecimiento empieza a apoderarse de nosotros.
Un pequeño número de células senescentes pueden provocar un caos generalizado. Aunque dejan de dividirse, siguen liberando pequeñas proteínas llamadas «citocinas» que causan inflamación y que atraen a células inmunes denominadas «macrófagos», que luego atacan el tejido. Estar inflamado de forma crónica no es sano: pregúntale a cualquiera con esclerosis múltiple, enfermedad inflamatoria intestinal o psoriasis. Todas estas enfermedades están asociadas a un exceso de proteínas citocinas. La inflamación también es una causa mayor de enfermedades cardiovasculares, diabetes y demencia. Es tan importante en el desarrollo de enfermedades relacionadas con la edad que los científicos a veces se refieren al proceso con el término inflammaging (derivado de «inflamación» y «envejecimiento» en inglés). Y las citocinas no solo causan inflamación; también hacen que otras células se conviertan en zombis, como un apocalipsis biológico. Cuando esto sucede, pueden incluso estimular a las células circundantes para que se conviertan en un tumor y se esparzan.
Ya sabemos que destruir células senescentes en ratones puede proporcionarles una vida significativamente más sana y larga; hace que los riñones les funcionen mejor durante más tiempo y que su corazón sea más resistente al estrés. Como resultado, su esperanza de vida es de entre un 20 y un 30 por ciento mayor, según la investigación dirigida por los biólogos moleculares de la Clínica Mayo Darren Baker y Jan van Deursen. En modelos animales de enfermedades, matar las células senescentes hace que los pulmones fibrosos se vuelvan más flexibles, ralentiza la progresión del glaucoma y de la osteoartritis, y reduce el tamaño de todo tipo de tumores.
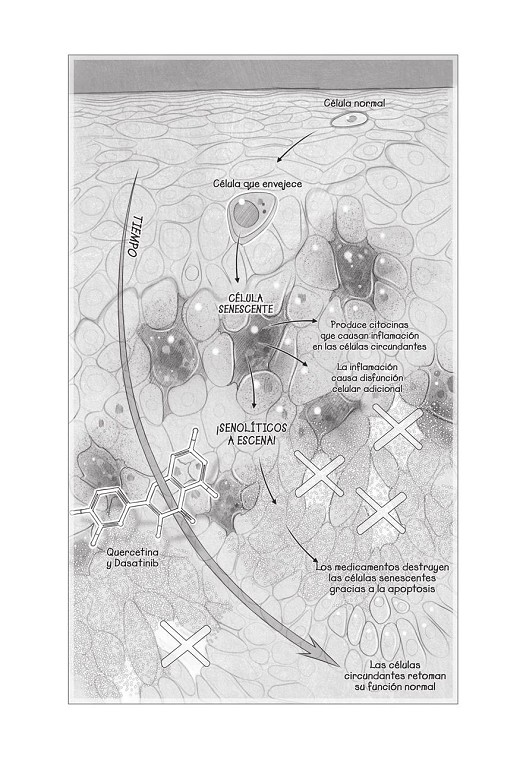
Entender por qué evolucionó la senescencia no es solo una cuestión académica; también podría ayudarnos a diseñar mejores formas de prevenir o de matar células senescentes. La senescencia celular es una consecuencia de los circuitos de supervivencia primordiales que hemos heredado, que evolucionaron para detener la división celular y la reproducción cuando se detectan roturas en el ADN. Al igual que en las células viejas de levadura, si el ADN se rompe con demasiada frecuencia o si las roturas sobrecargan el circuito, las células humanas dejarán de dividirse, se quedarán quietas presas del pánico, intentando reparar el daño, alterando su epigenoma y segregando citocinas. Esta es la etapa final del envejecimiento celular, y no es agradable.
Si las células zombis son tan malas para nuestra salud, ¿por qué no las mata nuestro cuerpo sin más? ¿Por qué se les permite a las células senescentes causar problemas durante muchos años? En la década de 1950, el biólogo evolutivo George Williams ya estaba trabajando en este asunto. Su trabajo, ampliado por Judith Campisi, del Instituto Buck para la Investigación del Envejecimiento, en California, sugiere que desarrollamos la senescencia como un buenísimo truco para evitar el cáncer cuando tenemos treinta o cuarenta años. Al fin y al cabo, las células senescentes no se dividen, lo que quiere decir que las células con mutaciones no pueden propagarse y formar tumores. Pero, si la senescencia evolucionó para evitar el cáncer, ¿por qué acabaría promoviéndolo en tejidos adyacentes, por no mencionar muchos otros síntomas relacionados con la edad?
Aquí es donde entra en escena la «pleiotropía antagonista»: la idea de que un mecanismo de supervivencia que es bueno para nosotros cuando somos jóvenes se ha mantenido a lo largo de la evolución porque, de momento, sus ventajas superan con creces cualquier problema que pueda causarnos cuando seamos mayores. Sí, la selección natural es cruel, pero funciona.
Piensa en los quince millones de historia de los homínidos, los grandes simios. En la inmensa mayoría del viaje evolutivo de nuestra familia, las fuerzas de la depredación, la hambruna, la mortalidad materna, la infección, las catástrofes ambientales y la violencia intraespecie se ha traducido en que muy pocos individuos conseguían superar una o dos décadas de vida. Incluso en la relativamente reciente era del género Homo, lo que ahora denominamos «mediana edad» es un fenómeno excepcional.
La esperanza de vida de cincuenta años o más sencillamente no ha existido durante la mayor parte de nuestra historia evolutiva. Por lo tanto, daba igual que un mecanismo que esparciera lentamente el cáncer causara más cáncer y otras enfermedades a la postre, porque solía funcionar, siempre y cuando le permitiera a la gente procrear y criar hijos. Los tigres diente de sable ya se encargaban de hacer el resto.
Por supuesto, hoy en día pocas personas tienen que preocuparse de que los atrape un depredador hambriento. La hambruna y la malnutrición siguen siendo demasiado habituales, pero la muerte por inanición empieza a ser cada vez más excepcional. Cada vez somos mejores a la hora de eliminar enfermedades infantiles y casi hemos erradicado algunas de ellas. El parto es cada vez más seguro (aunque esto también se puede mejorar muchísimo, sobre todo en los países en desarrollo). La higiene moderna tiene como resultado una mejora sustancial en los porcentajes de muertes por enfermedades infecciosas. La tecnología moderna nos ayuda a estar alerta a catástrofes inminentes, como los huracanes o las erupciones volcánicas. Y, aunque a veces el mundo parece un lugar violento y despiadado, la tasa de homicidios mundial y el número de guerras llevan décadas disminuyendo.
De modo que vivimos más tiempo y a la evolución no le ha dado tiempo a ponerse al día. Estamos rebosantes de células senescentes, que bien podrían ser desechos radiactivos. Si pones una diminuta muestra de estas células bajo la piel de un ratón joven, no tardarán mucho en esparcir la inflamación y en que todo el ratón acabe lleno de las células zombis que provocan los signos de envejecimiento prematuro.
Una clase de fármacos llamados «senolíticos» podría ser el asesino de zombis que necesitamos para combatir el envejecimiento en este frente. Estos medicamentos compuestos de pequeñas células están diseñados para matar células senescentes de forma específica induciendo el programa mortal que debería haberse puesto en marcha en un principio.
Esto es lo que ha hecho James Kirkland, de la Clínica Mayo. Solo necesitó un rápido tratamiento con dos moléculas senolíticas (la quercetina, que se encuentra en las alcaparras, la col rizada y la cebolla roja; y un medicamento llamado «dasatinib», que es un tratamiento de quimioterapia estándar para la leucemia) para eliminar las células senescentes en ratones de laboratorio y alargar su esperanza de vida un 36 por ciento. Las implicaciones de este trabajo no se pueden pasar por alto. Si los senolíticos funcionan, podrías tomarte una dosis de medicamento, rejuvenecer y volver diez años más tarde a por otra dosis. Mientras tanto, los mismos medicamentos se podrían inyectar en una articulación osteoartrítica o en un ojo ciego, o introducirla en los pulmones fibrosos e inflexibles por la quimioterapia para darles también un chute de antienvejecimiento. (La rapamicina, la molécula de la longevidad de la Isla de Pascua, se conoce como una molécula «senomórfica», dado que no mata las células senescentes, pero sí les impide liberar moléculas inflamatorias, que puede ser algo casi igual de bueno.)
Los primeros ensayos clínicos con senolíticos en seres humanos empezaron en 2018 para tratar la osteoartritis y el glaucoma, enfermedades en las cuales se acumulan las células senescentes. Tendrán que pasar unos cuantos años antes de que sepamos lo suficiente sobre los efectos y la seguridad de estos medicamentos como para dárselos a todo el mundo; pero, si funcionan, su potencial es enorme.
Claro que hay otra opción, solo un poquito más arriba, que podría ser incluso mejor.
LA GUÍA DEL AUTOESTOPISTA
Los genes egoístas de los que hablamos antes, llamados «retrotransposones LINE-1», y sus remanentes fósiles componen alrededor de la mitad del genoma humano, lo que a menudo se denomina «ADN basura».
Es un montón de equipaje genético y son unos tíos muy listos. En las células jóvenes, la cromatina evita que estos antiguos «elementos móviles del ADN», también conocidos como «retrotransposones», salten del genoma para luego romper el ADN a fin de reinsertarse en otra parte. Tanto nosotros como otros investigadores hemos demostrado que los genes LINE-1 se compactan y se silencian gracias a las sirtuinas. Pero, a medida que los ratones envejecen, y posiblemente a medida que nosotros también lo hacemos, estas sirtuinas quedan repartidas por todo el genoma, tras haber sido requeridas en otra parte para reparar las roturas en el ADN, y muchas de ellas nunca encuentran el camino de vuelta a casa. Esta pérdida se acentúa por una bajada de los niveles de NAD, lo mismo que vimos por primera vez en la levadura vieja. Sin sirtuinas que compacten la cromatina y que silencien el ADN transposón, las células empiezan a transcribir estos virus endógenos.
Esto es malo. Y la cosa va a peor.
Con el tiempo, a medida que los ratones envejecen, los prisioneros de LINE-1, que antes estaban silentes, se convierten en ARN y este se convierte en ADN, que se reinserta en el genoma en un lugar distinto. Además de crear inestabilidad en el genoma y ruido epigenético que provoca inflamación, el ADN LINE-1 se sale del núcleo y se filtra en el citoplasma, donde se reconoce como un invasor. En respuesta, las células liberan más citocinas inmunoestimulantes que provocan inflamación por todo el cuerpo.
Un nuevo trabajo de John Sedivy, de la Universidad de Brown, y de Vera Gorbunova, de la Universidad de Rochester, plantea la posibilidad de que uno de los motivos principales de que los ratones con SIRT6 mutante envejezcan tan rápido es que estos sabuesos retrovirales no tienen correa que los detenga, provocando así numerosas roturas en el ADN y que el epigenoma se degrade con rapidez en vez de poco a poco. Algunos experimentos han dado pruebas convincentes de que los antirretrovirales, como los usados para combatir el VIH, llegan a duplicar la esperanza de vida de los ratones con SIRT6 mutante. Puede que, a medida que los niveles de NAD se reducen con la edad, las sirtuinas se vean incapaces de silenciar el ADN transposón. Tal vez llegue el día en el que se usen antirretrovirales seguros o estimuladores de NAD para mantener silenciados a estos genes móviles. No habremos cortado el envejecimiento de raíz, pero estaríamos librando la batalla antes de que se desate la anarquía absoluta y cueste mucho más devolver a su botella al genio que es el envejecimiento.
VACUNAS PARA EL FUTURO
En 2018, un grupo de científicos de la Universidad de Stanford anunció que habían desarrollado una inoculación que reducía significativamente el porcentaje de ratones que sufría de cáncer de mama, de pulmón y de piel. Al inyectarles a los ratones células madre inactivas gracias a la radiación y al añadir más tarde una vacuna de recordatorio como la que los seres humanos usamos para el tétanos, la hepatitis B y la tosferina, las células madre preparaban el sistema inmune para atacar tipos de cáncer que normalmente serían invisibles al sistema inmune. Otros enfoques inmunoncológicos están dando avances todavía mayores. Las terapias como los inhibidores de PD-1 y de PD-L1, que exponen las células cancerígenas para que se puedan matar, y las terapias de células T con receptores de antígenos quiméricos (CAR-T, por sus siglas en inglés), que modifican los linfocitos T del paciente y los reinyecta para matar las células cancerígenas, están salvándoles la vida a personas a las que, hace pocos años, les habrían dicho que volvieran a casa para preparar su entierro. Ahora algunos de estos pacientes tienen una segunda oportunidad para seguir viviendo.
Si podemos usar el sistema inmune para matar células cancerígenas, tiene sentido que podamos hacer lo mismo con las células senescentes. Y algunos científicos ya están manos a la obra. Judith Campisi, del Instituto Buck para la Investigación del Envejecimiento, y Manuel Serrano, de la Universidad de Barcelona, creen que las células senescentes, como las cancerígenas, permanecen invisibles al sistema inmune agitando un cartelito proteico que reza: «Aquí no hay células zombis».
Si Campisi y Serrano están en lo cierto, deberíamos ser capaces de eliminar esos cartelitos y darle permiso al sistema inmune para matar células senescentes. Tal vez, dentro de unas décadas, el calendario de vacunas que ahora protege a los bebés contra la polio, el sarampión, las paperas y la rubeola también incluya una vacuna para evitar la senescencia cuando lleguemos a la mediana edad.
Cuando la gente oye por primera vez que podría haber una vacuna contra el envejecimiento, en vez de tratar únicamente los síntomas o retrasar su avance, es muy habitual que expresen su preocupación por la posibilidad de que «estemos jugando a ser Dios» o de que «estemos interfiriendo con la madre naturaleza». Tal vez sea así, pero, de ser verdad, no es algo que solo suceda con las personas que luchan contra el envejecimiento. Luchamos contra toda clase de enfermedades que Dios o la madre naturaleza nos han dado. Llevamos haciéndolo muchísimo tiempo y vamos a seguir haciéndolo durante mucho más.
El mundo celebró con razón que se erradicara la viruela en 1980. Cuando por fin se erradique la malaria (y creo que se conseguirá en las décadas venideras), la comunidad global lo celebrará una vez más. Y si pudiera ofrecerle al mundo ahora mismo una vacuna contra el VIH, no habría mucha gente (gente decente, al menos) que dijera que deberíamos dejar que «la naturaleza siga su curso». Claro que todas estas dolencias se consideran enfermedades desde hace mucho tiempo, y acepto que tardaremos en convencer a las personas de que el envejecimiento es el mismo caso.
Con este fin, el siguiente experimento mental me parece útil: imagina un Airbus A380, un jumbo enorme de dos pisos con seiscientas personas a bordo, que se acerca a Los Ángeles. El avión no tiene tren de aterrizaje, solo paracaídas, y todas las puertas menos una están atascadas, de modo que, cuando los pasajeros evacúan el avión, uno a uno, acaban desperdigados por la zona con mayor densidad de población del país.
Ah, y una cosa más: los pasajeros están enfermos, mucho. La enfermedad que portan es muy contagiosa; empieza con letargo y dolor en las articulaciones y después se desarrolla pérdida de la visión y del oído, y las señales cerebrales sufren tantas interferencias que muchas víctimas no podrán recordar siquiera su nombre. Nadie sobrevive a la enfermedad y la muerte es casi siempre agónica.
Tras una larga vida de servicio a Estados Unidos, te ves sentado al escritorio Resolute del despacho oval de la Casa Blanca. Suena el teléfono. El subdirector de enfermedades infecciosas del Centro para la Prevención y el Control de Enfermedades te dice que, con que un único pasajero salte en paracaídas en la zona de Los Ángeles, decenas de miles de personas se contagiarán y morirán. Cada paracaidista aumentará exponencialmente el número de muertes proyectadas.
Nada más colgar el teléfono, vuelve a sonar. El comandante de la Junta de Jefes de Estado te dice que seis cazas F-22 de las Fuerzas Áreas de Estados Unidos están siguiendo al avión mientras sobrevuela el océano Pacífico. Los pilotos lo tienen en su visor y los misiles están preparados. El avión se está quedando sin combustible. El destino de los pasajeros, y el de todo Estados Unidos, depende de ti.
¿Qué harías?
Por supuesto, se trata de un «dilema del tranvía», un experimento mental ético, del tipo que popularizó la filósofa Philippa Foot, que contrapone nuestro deber moral de no hacer daño a los demás y nuestra responsabilidad social de salvar el mayor número de vidas posible. Sin embargo, también es una metáfora muy apropiada, porque la contagiosísima enfermedad que portan los pasajeros es, como sin duda te habrás percatado, solo una versión acelerada del envejecimiento.
Cuando se nos presenta la idea de una enfermedad que podría infectar y matar a miles de personas (con síntomas espantosos, además), muy pocos no tomaríamos la horrible aunque necesaria decisión de derribar el avión, llevándonos la vida de cientos de personas para proteger la de millones.
Con esto en mente, piensa en la siguiente cuestión: si estás dispuesto a sacrificar a cientos de personas para que una versión acelerada del envejecimiento no infecte a millones de personas, ¿qué estarías dispuesto a hacer para evitar la enfermedad que de verdad padecemos todos los que vivimos en este planeta?
No te preocupes: lo que voy a sugerir no se cobrará vidas humanas, ni de cientos, ni de decenas ni ninguna. Pero nos exigirá enfrentarnos a una idea que a muchas personas les resultará alarmante: infectarnos conscientemente con un virus que se introducirá rápidamente en todas y cada una de nuestras células, convirtiéndonos así en organismos genéticamente modificados. El virus no matará, hará todo lo contrario.
HORA DE REPROGRAMAR
Las vacunas contra las células senescentes, los miméticos de CR y los supresores de retrotransposones son posibles vías para prolongar la vitalidad, y laboratorios y clínicas de todo el mundo ya están trabajando con ellos. Pero ¿y si no hiciera falta nada de esto? ¿Y si pudiéramos resetear el reloj del envejecimiento y evitar que las células perdieran su identidad y se convirtieran en senescentes?
Sí, la solución al envejecimiento podría ser una reprogramación celular, un reseteo del paisaje, por ejemplo, tal como han demostrado hacer las medusas usando pequeños fragmentos corporales para regenerar pólipos que dan lugar a decenas de nuevas medusas.
Al fin y al cabo, el plano del ADN para ser joven siempre está ahí, aun cuando somos viejos. Así que ¿cómo podemos hacer que las células lo relean? Ahora resulta útil retomar mi metáfora del DVD. Con el tiempo, debido al uso y tal vez al abuso, la información digital codificada en pistas sobre la capa superficial de aluminio se vuelve oscura por los arañazos, unos profundos y otros superficiales, haciendo que al reproductor de DVD le cueste leer el disco. Un DVD tiene casi cincuenta kilómetros de datos enroscados alrededor del disco desde el perímetro exterior hasta el centro, de modo que, si se raya el disco, encontrar el principio de una canción determinada se vuelve dificilísimo.
Lo mismo sucede con las células viejas, pero mucho peor. El ADN presente en nuestras células contiene más o menos la misma cantidad de datos que un DVD, pero en menos de dos metros de ADN compactado en una célula menor que una décima parte de una molécula de polvo. Junto, todo el ADN de tu cuerpo, si lo estiramos, abarcaría el doble del diámetro del sistema solar. Aunque, a diferencia de un simple DVD, el ADN de nuestras células está mojado y vibra en tres dimensiones. Y no hay cincuenta canciones, hay más de veinte mil. Con razón, leer los genes se hace más difícil con la edad; es un milagro que las células encuentren el gen correcto.
Hay dos formas de reproducir un DVD viejo y rayado con fidelidad. Podrías comprar un lector de DVD mejor, uno con un láser más potente que revele los datos bajo los arañazos. O podrías pulir el disco para dejar al descubierto otra vez la información, dejando el DVD como nuevo. Me han contado que pasarles un trapo con pasta de dientes los deja estupendos.
Restaurar la juventud en un organismo nunca va a ser tan sencillo como pulir un disco con pasta de dientes, pero el primer enfoque, el de meter el DVD rayado en un lector nuevo, sí. El profesor John Gurdon, de la Universidad de Oxford, lo hizo por primera vez en 1958, cuando eliminó los cromosomas de un ovocito de rana y los reemplazó con los cromosomas de una rana adulta para obtener renacuajos vivos. Después, en 1996, Ian Wilmut y sus colegas de la Universidad de Edimburgo reemplazaron los cromosomas de un óvulo de oveja con los de la célula de una ubre. El resultado fue Dolly, cuyo nacimiento suscitó un acalorado debate público sobre los supuestos peligros de la clonación.
El debate eclipsó lo más importante: el ADN viejo retiene la información necesaria para volver a ser joven.
Esta discusión ha decaído desde entonces; hay otras preocupaciones en el mundo. La clonación ahora se hace de forma rutinaria para producir animales de granja, caballos de carreras e incluso mascotas. En 2017 podías pedir un clon de perro por el «módico» precio de cuarenta mil dólares… o incluso dos, tal como hizo Barbra Streisand para reemplazar a su querida Sammie, una Cotón de Tulear de pelo rizado. El hecho de que Sammie tuviera catorce años cuando murió y donó sus células (que equivalen a unos setenta y cinco años humanos), no tuvo impacto alguno en los clones.
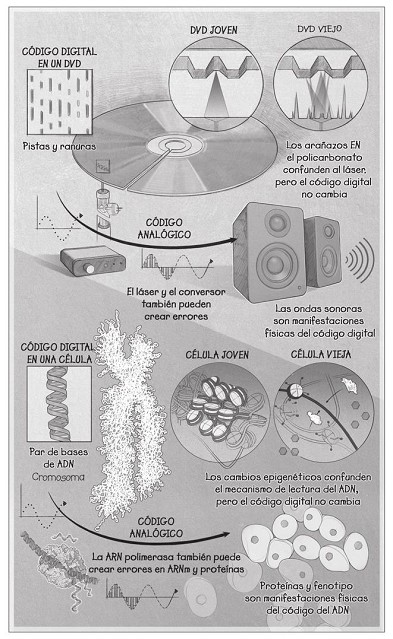
Las implicaciones de estos experimentos son profundas. Demuestran que el envejecimiento se puede resetear. Se pueden eliminar los arañazos del DVD y se puede recuperar la información original. El ruido epigenético no es una calle de un solo sentido.
Pero ¿cómo podríamos resetear el cuerpo sin convertirnos en un clon?
En sus artículos de 1948 acerca de la conservación de la información durante las transmisiones de datos, Claude Shannon aportó una pista muy valiosa.[0]
En un sentido abstracto, sugirió que la pérdida de información solo es un aumento de entropía, o la incertidumbre de resolver un mensaje, y proporcionó ecuaciones brillantes para apoyar sus ideas. Su trabajo partía de las matemáticas de Harry Nyquist y Ralph Hartley, dos ingenieros de Bell Labs que, en los años veinte del siglo pasado, revolucionaron nuestra comprensión de la transmisión de información. Sus nociones de un «código ideal» fueron importantes en el desarrollo de la teoría de la comunicación de Shannon.
En la década de 1940, este se obsesionó con las comunicaciones en un canal ruidoso, en el que la información solo es una serie de mensajes posibles que el destinatario (el receptor) tiene que reconstruir.
Tal como demostró con brillantez en su «teorema de codificación de canales con ruido», es posible comunicar información casi sin errores mientras que no se exceda la capacidad del canal. Pero si los datos exceden la capacidad del canal o están sometidos a ruido, como suele ocurrir con los datos analógicos, lo mejor para asegurarse de que le llegan al receptor es almacenar una copia de seguridad de los datos. De esa forma, aunque se pierdan algunos datos primarios, un «observador» puede enviar los «datos de corrección» a un «dispositivo correctivo» para recuperar el mensaje original. Así funciona internet. Si se pierden paquetes de datos, al poco se recuperan y se reenvían, todo gracias al protocolo de control de transmisión/protocolo de internet (TCP/IP, por sus siglas en inglés).
Tal como dijo Shannon, «el observador se percata de los errores en el mensaje recuperado y transmite los datos al punto receptor a través de un “canal de corrección” para permitirle al receptor corregir los errores».
Aunque esto puede sonar a galimatías de los años cuarenta, en 2014 caí en la cuenta de que el artículo de Shannon «Una teoría matemática de la comunicación» es relevante para la teoría del envejecimiento por pérdida de información.
Según él, hay tres componentes distintos que tienen análogos en biología:
• La «fuente» de la información son el óvulo y el esperma de tus padres.
• El «transmisor» es el epigenoma, que transmite información analógica a través del espacio y el tiempo.
• El «receptor» es tu cuerpo en el futuro.
Cuando se fecunda un óvulo, se envía la información epigenética, es decir, «señales de radio» biológicas. Esta información viaja a través de células en división y del tiempo. Si todo va bien, el óvulo se desarrolla y se convierte en un bebé sano y, después, en un adolescente sano. Pero, con la sucesiva división celular y la reacción exagerada del circuito de supervivencia ante las roturas en el ADN, la señal se vuelve cada vez más ruidosa. A la postre, el receptor, que es tu cuerpo con ochenta años, ha perdido gran parte de la información original.
Sabemos que es posible clonar un renacuajo o un mamífero a partir de un ejemplar viejo. De modo que, aunque se pierda mucha información epigenética en la vejez, oculta por el ruido epigenético, tiene que haber información que les diga a las células cómo resetearse. Esta información fundamental, impuesta a principios de la vida, es capaz de decirle al cuerpo cómo ser joven de nuevo, y esto sería el equivalente de una copia de seguridad de los datos originales.
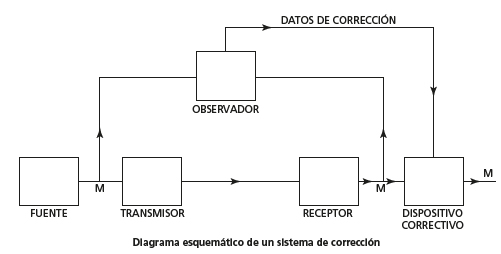
Para acabar con el envejecimiento tal y como lo conocemos, tenemos que encontrar tres cosas más que Shannon sabía que eran esenciales para que se pudiera restaurar la señal, aunque estuviera distorsionada por el ruido:
• Un «observador» que grabe los datos originales.
• Los «datos de corrección» originales.
• Y un «dispositivo correctivo» para restaurar la señal original.
Creo que tal vez hayamos encontrado por fin el dispositivo correctivo biológico.
En 2006, el investigador japonés Shinya Yamanaka, que trabaja con células madre, anunció al mundo que, después de probar numerosas combinaciones de genes, había descubierto que un conjunto de cuatro (Oct4, Klf4, Sox2 y c-Myc) podía inducir a células adultas a convertirse en células madre pluripotentes (iPSC, por sus siglas en inglés), que son células inmaduras que pueden ser persuadidas para que se conviertan en cualquier tipo de célula. Estos cuatro genes codifican factores de transcripción potentes que controlan conjuntos enteros de más genes que mueven las células en el paisaje de Waddington durante el desarrollo embrionario. Estos genes se encuentran en la mayoría de las especies pluricelulares, incluidos los chimpancés, los monos, los perros, las vacas, los ratones, las ratas, los pollos, los peces y las ranas. Por su descubrimiento, que básicamente demostró que es posible la reversión total de la edad celular en una placa de Petri, Yamanaka ganó el Premio Nobel de Fisiología o Medicina junto con John Gurdon en 2012. Ahora denominamos a estos cuatro genes «factores Yamanaka».
A primera vista, los experimentos de Yamanaka pueden parecer un truco de laboratorio muy complicado. Sin embargo, las implicaciones para el envejecimiento son profundas, y no solo porque nos allanó el camino para cultivar nuevas poblaciones de células sanguíneas, tejidos y órganos en laboratorio que pueden ser, y son en efecto, trasplantados a los pacientes.
Creo que identificó el interruptor de reseteo responsable de los renacuajos de Gurdon, el dispositivo correctivo biológico.
Predigo, y ahora mismo mis estudiantes lo están demostrando en el laboratorio, que podemos usar tanto este interruptor como otros no solo para resetear nuestras células en placas de Petri, sino para resetear por completo el paisaje epigenético del cuerpo (que las canicas vuelvan a los valles que les corresponden), enviando las sirtuinas de vuelta al lugar del que salieron, por ejemplo. Las células que han perdido su identidad durante el envejecimiento pueden recuperar su verdadero yo. Es el pulimento para DVD que hemos estado buscando.
Hacemos progresos cada semana en la restauración del epigenoma joven en ratones dándoles factores de reprogramación. El ritmo de los descubrimientos es apabullante. A los miembros de mi laboratorio y a mí nos cuesta recordar cuándo fue la última vez que dormimos una noche del tirón.
En la década de 1990, había una tremenda preocupación por la seguridad en la entrega de genes a los seres humanos. Pero cada vez es mayor el número de productos para terapias genéticas y hay cientos de ensayos clínicos en marcha. Por ejemplo, los pacientes con una mutación de RPE65 que causa ceguera pueden curarse con una sencilla inyección de un virus seguro que infecta la retina y que les da, para siempre, el gen RPE65 funcional.
Predigo que la reprogramación celular del cuerpo se empleará para tratar en primer lugar enfermedades relacionadas con el envejecimiento en el ojo, como el glaucoma o la degeneración macular (el ojo es el órgano predilecto para ensayar terapias genéticas porque está aislado inmunológicamente). Pero, si la terapia es lo bastante segura para administrarla al resto del cuerpo, tal como los estudios a largo plazo con ratones realizados en mi laboratorio sugieren que podría suceder algún día, nuestro futuro podría ser el siguiente:
A los treinta años, recibirías tres inyecciones en una semana que te inocularían un virus adenoasociado (AAV, por sus siglas en inglés) diseñado para la ocasión que te provocaría una reacción inmune nimia, incluso menor que la provocada por la vacuna de la gripe. El virus, conocido por los científicos desde los años sesenta del siglo pasado, ha sido modificado para que no se propague ni provoque enfermedad alguna. Lo que esta versión teórica del virus portaría sería un pequeño número de genes (tal vez una combinación de los factores Yamanaka) y un sistema de seguridad que se podría activar con una molécula tolerable como la doxiciclina, un antibiótico que se puede tomar en pastillas, o, mejor todavía, una que sea totalmente inerte.
A esas alturas, nada cambiaría en la forma de trabajar de tus genes. Pero cuando empieces a ver y a sentir los efectos del envejecimiento, ya con cuarenta y tantos años, te recetarían un mes de doxiciclina. Con eso se activarían los genes de la reprogramación.
Durante el proceso, seguramente tendrás que dejar una gotita de sangre en un biomonitor casero o tendrás que hacerle una visita al médico para asegurarte de que todo funciona como debería, pero ya está. A lo largo del siguiente mes, tu cuerpo sufrirá un proceso de rejuvenecimiento a medida que las canicas de Waddington regresan al lugar que ocupaban cuando eras joven. Las canas desaparecerían. Las heridas se curarían antes. Las arrugas se borrarían. Los órganos se regenerarían. Pensarías más rápido, oirías sonidos más agudos y ya no necesitarías gafas para leer de cerca. Tu cuerpo se sentiría joven de nuevo.
Al igual que Benjamin Button, volverías a sentirte como si tuvieras treinta y cinco años. Luego treinta. Y luego veinticinco.
Pero, a diferencia de Benjamin Button, te detendrías ahí. Dejarías de tomar el medicamento. El AAV se desactivaría. Los factores Yamanaka se silenciarían. Biológica, física y mentalmente tendrías un par de décadas menos, pero conservarías tus conocimientos, tu sabiduría y tus recuerdos.
Volverías a ser joven de nuevo, pero no solo lo aparentarías, sino que serías joven de verdad, libre para pasar las siguientes décadas de tu vida sin los achaques ni los dolores de la mediana edad, sin preocuparte por la posibilidad de un cáncer o de una enfermedad cardiovascular. Después, unas décadas más adelante, cuando empezaran a salirte canas de nuevo, iniciarías otro ciclo del desencadenante recetado.
Más aún: dado el ritmo al que avanza la biotecnología, y a medida que aprendemos más acerca de cómo manipular los factores que resetean nuestras células, tal vez seamos capaces de dejar de usar virus y tomar sin más pastillas durante un mes.
¿Parece ciencia ficción? ¿Algo que está a años luz? Voy a decirlo sin rodeos: no.
Manuel Serrano, el jefe del laboratorio de Plasticidad Celular y Enfermedad en el Instituto de Investigación Biomédica de Barcelona, y Juan Carlos Izpisua Belmonte, del Instituto Salk de Estudios Biológicos de San Diego, ya han diseñado ratones que cuentan con todos los factores Yamanaka desde su nacimiento; estos se pueden activar inyectando doxiciclina a los ratones. En un famoso estudio de 2016, cuando Belmonte desencadenó los factores Yamanaka durante dos días a la semana a lo largo de toda la vida de un tipo de ratón envejecido prematuramente llamado LMNA, los ratones permanecieron más jóvenes en comparación con sus hermanos sin tratar y vivieron un 40 por ciento más. También ha demostrado que la piel y los riñones de los ratones viejos normales se curan más rápido.
Sin embargo, el tratamiento Yamanaka era muy tóxico. Si Belmonte se pasaba dándoles a los ratones el antibiótico durante más de unos días, morían. Serrano también demostró que, al alejar demasiado las canicas del paisaje, la combinación de los cuatro genes podía inducir teratomas, que son un tipo de tumores especialmente desagradables compuestos de varias clases de tejidos, como pelo, músculo o hueso. Es evidente que esta tecnología no está preparada para dar el gran salto. Al menos, no de momento. Pero cada día que pasa nos acercamos más a la posibilidad de controlar las canicas de Waddington con seguridad, de asegurarnos de que regresan justo a sus valles originales y no a la cima de la montaña, donde podrían provocar cáncer.
Mientras todo esto sucedía, guiado por el éxito de los experimentos con ratones ICE, mi laboratorio había estado buscando maneras de retrasar y revertir el envejecimiento epigenético. Lo intentamos con diferentes enfoques: el gen Notch, Wnt, los cuatro factores Yamanaka… Algunos funcionaron un poquito, pero la mayoría se estaban convirtiendo en células tumorales.
Un día de 2016, después de fracasar de forma continua durante dos años a la hora de conseguir la reversión de la edad de células viejas sin que se convirtieran en tumorales, un brillante estudiante de grado llamado Yuancheng Lu entró en mi despacho para decirme que estaba a un paso de abandonar. Como último esfuerzo, sugirió que probaría a dejar fuera el gen c-Myc, que seguramente era el causante de los teratomas, y yo lo animé a hacerlo.
Les suministró un paquete viral a los ratones, pero en esta ocasión con solo tres de los cuatro factores Yamanaka; luego los activó con doxiciclina y esperó a que todos los ratones enfermaran o se murieran. Pero ninguno lo hizo. Estaban perfectamente. Y después de meses de control, tampoco aparecieron tumores. Fue una sorpresa para los dos, una grata sorpresa.
En vez de esperar otro año para comprobar si los ratones vivían más tiempo, Yuancheng sugirió que usaría el nervio óptico de un ratón como método para comprobar la reversión de la edad y el rejuvenecimiento. Yo tenía mis dudas.
—No soy muy optimista en cuanto a los resultados —le dije—. Los nervios ópticos no se regeneran sin más, a menos que seas un recién nacido.
La complicada red de células y de fibras que trasmiten las señales nerviosas por todo nuestro cuerpo se divide en dos partes: el sistema periférico y el sistema central. Desde hace mucho tiempo sabemos que los nervios periféricos, como los de los brazos y las piernas, pueden volver a crecer, aunque muy pero que muy despacio. En cambio, los nervios del sistema central (los nervios ópticos y los nervios de la columna vertebral) nunca crecen de nuevo. Hasta los científicos que no se ceñían a las convenciones, que proponían terapias novedosas que podían regenerar algunos aspectos del sistema central, se han mostrado siempre comedidos a la hora de aceptar un potencial recrecimiento que fuera significativo. Décadas de trabajo destinadas a revertir el glaucoma ocular y los daños de la espina dorsal y casi no ha habido avance alguno.
—Has escogido el problema de la biología más difícil de resolver —le dije a Yuancheng.
—Pero si pudiéramos solucionar ese problema… —repuso.
Podría haber miles de formas de medir el impacto de la reversión de la edad en ratones, pero, alentado por su reciente éxito, decidí «lanzarme a la piscina». Me gustaba.
—Nadie cambia el mundo sin asumir riesgos —le dije—. Compruébalo.
Las imágenes que me llegaron por mensaje unos cuantos meses después me dejaron sin aliento, tanto que tuve que asegurarme de que lo que veía era real.
Llamé a Yuancheng de inmediato.
—¿Estoy viendo lo que creo?
—Puede —contestó—. ¿Qué ves?
—El futuro —respondí.
Yuancheng soltó un enorme suspiro de alivio.
—David —me dijo—, hace una hora creía que iba a fracasar.
Para los investigadores, la duda no es un vicio, es una consecuencia muy normal y muy humana de obligarte a hacer cosas audaces sin saber cómo van a salir.
Pero aquel día las cosas parecían estar saliendo de maravilla. La imagen que Yuancheng me envió semejaba una brillante medusa naranja; tenía la cabeza en la parte superior, donde está el ojo del ratón, con largos tentáculos que flotaban hacia el cerebro. Dos semanas antes, Yuancheng y nuestros colaboradores habían aplastado unos milímetros el nervio óptico de la parte posterior del ojo con la ayuda de unas pinzas, haciendo que casi todos los axones de la célula nerviosa, los tentáculos, se marchitaran lejos del cerebro. Inyectaron un tinte orgánico fluorescente en el ojo para impregnar las neuronas vivas. De modo que, cuando Yuancheng miró a través del microscopio el punto del aplastamiento, no había nervios brillantes, solo una masa de células muertas.
La siguiente imagen que me envió fue un ejemplo del lugar en el que habían activado el virus de reprogramación tras el aplastamiento. En vez de células muertas, una red de tentáculos largos, sanos y móviles se abría camino para conectarse con el cerebro. Fue el mejor ejemplo de regeneración nerviosa de toda la historia, y Yuancheng solo estaba empezando.
Nadie se había esperado, ni por asomo, que la reprogramación funcionara tan bien. Se habían escogido ratones de un mes de vida para estos experimentos para tener las mayores oportunidades de éxito y porque eso era lo que hacía todo el mundo. Sin embargo, Yuancheng y nuestros habilidosos colaboradores en el laboratorio del profesor Zhigang He del Hospital Infantil de la Escuela de Medicina de Harvard ya han probado nuestro régimen de reprogramación en los nervios ópticos dañados de ratones de mediana edad (unos doce meses). Sus nervios también se regeneran.
Mientras escribo esto, hemos restaurado la visión en ratones viejos normales.
La visión empeora de forma brutal en un ratón de unos doce meses de edad. Bruce Ksander y Meredith Gregory-Ksander, del centro de investigación Massachusetts Eye and Ear, en Harvard, lo saben bien. Se produce una pérdida de los impulsos nerviosos en la retina y los ratones viejos no mueven tanto la cabeza cuando se les muestran líneas en movimiento, por la sencilla razón de que no las ven.
—David, tengo que admitir que no me esperaba que esto de la reprogramación funcionara en ojos envejecidos normales —me dijo Bruce—. He probado tu virus solo porque tenías muchas ganas de que lo hiciera.
El resultado que había visto la mañana anterior supuso que aquel día fuera el más emocionante de su carrera investigadora: nuestro virus reprogramador OSK había restaurado la visión.
Unas semanas más tarde, Meredith demostró que la reprogramación también sirve para revertir la pérdida de visión provocada por la presión interna del ojo, dolencia conocida como «glaucoma».
—¿Sabes lo que hemos descubierto? —preguntó Bruce—. Todo el mundo ha estado trabajando en la ralentización del avance del glaucoma. ¡Este tratamiento restaura la visión!
Si se pueden reprogramar células adultas del cuerpo, incluso nervios viejos, para recuperar un epigenoma joven, la información de ser joven no se puede haber perdido del todo. Debe de haber un repositorio con los datos de corrección, una copia de seguridad de los datos o de faros moleculares, que se conserva durante la edad adulta y al que se puede acceder mediante los factores Yamanaka para resetear el epigenoma usando el equivalente celular del TCP/IP.
Aún no estamos seguros de cuáles son esos marcadores de juventud. Seguramente impliquen grupos metilo en el ADN, que se usan para calcular la edad de un organismo, el llamado reloj de Horvath. También es muy posible que impliquen algo más: una proteína, un ARN o incluso un novedoso químico pegado al ADN que todavía no hemos descubierto. Pero estén hechas de lo que estén hechas, son importantes, ya que serían los datos de corrección fundamentales que las células conservan a lo largo de la vida y que, de alguna manera, orquestan un reinicio.
También tenemos que encontrar al observador, aquel que graba las señales originales cuando somos jóvenes. No puede ser la metilación del ADN sin más, porque eso no explica cómo las células reprogramadas se concentran en algunos de los grupos metilo jóvenes y eliminan los que se acumulan durante el envejecimiento, el equivalente celular a los arañazos de un DVD. Tal vez sea una histona especializada, o un factor de transcripción, o una proteína que se adhiere al ADN metilado mientras nos estamos desarrollando en el útero y que se queda ahí durante ochenta años a la espera de una señal del dispositivo correctivo para restaurar la información original.
En la jerga de Claude Shannon, cuando se activa el dispositivo correctivo tras infectar las células con los genes OSK, la célula, de algún modo, sabe cómo contactar con el observador y usar los datos de corrección para restaurar la señal original de una célula joven.
Recrecer nervios y restaurar la visión no era suficiente para Yuancheng. Cuando se examinó el ADN de las neuronas dañadas, parecían estar pasando por un proceso de envejecimiento muy rápido que se contrarrestaba con los factores de reprogramación. Las neuronas que recibían los factores de reprogramación no envejecían… ni morían. Es una idea radical, pero tiene mucho sentido: una herida celular grave sobrecarga el circuito de supervivencia y acelera el envejecimiento de la célula, lo que conduce a la muerte, a menos que se pueda revertir el reloj de alguna forma.
Con estos descubrimientos tal vez estemos a punto de entender qué da cuerda al reloj biológico y cómo podemos hacerlo retroceder. Gracias a nuestros experimentos, sabemos que el dispositivo correctivo de información biológica necesita unas enzimas llamadas «enzimas de translocación diezonce» (TET, por sus siglas en inglés) que eliminan grupos metilo del ADN, las mismas etiquetas químicas que marcan el paso del tiempo del reloj de Horvath del envejecimiento. No es una coincidencia, y señala al reloj de metilación del ADN no solo como un indicador de la edad, sino como un controlador de esta. Es la diferencia entre un reloj de muñeca y el tiempo físico.
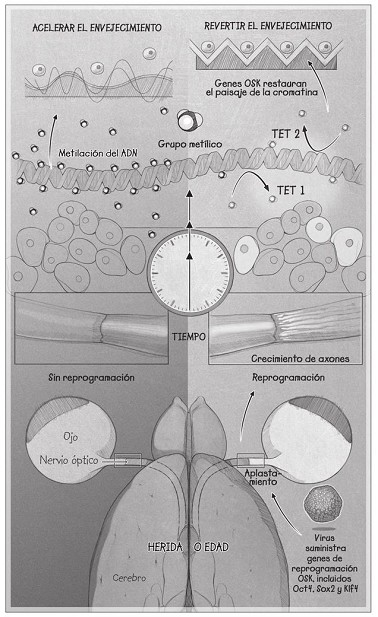
En su papel como componente del dispositivo correctivo, las TET no pueden eliminar todos los grupos metilo del genoma, porque eso convertiría a una célula en una célula madre primordial. No tendríamos ratones viejos que pueden ver mejor, sino ratones viejos con tumores. Es todo un misterio cómo saben las TET que solo tienen que eliminar los grupos metilo más recientes y al tiempo conservar los originales.
Seguramente tardaremos otra década y necesitaremos el trabajo de muchos laboratorios para saber con precisión el equivalente biológico del sistema de recuperación de información de TCP/IP. Pero, sea lo que sea, la visión que no deberíamos poder restaurar está siendo restaurada y las células que no deberían poder crecer de nuevo lo están haciendo.
Comparado con las décadas de investigación dedicadas a ralentizar el envejecimiento y la aparición de enfermedades relacionadas con la edad en un porcentaje mínimo, el trabajo de reprogramación ha sido relativamente rápido y sencillo. Solo hizo falta una idea audaz y el valor de saltarse las convenciones.
El futuro parece interesante, cuando menos. Si podemos arreglar lo más difícil de arreglar y regenerar las células del cuerpo más difíciles de regenerar, no hay motivos para creer que no podemos hacer que crezca de nuevo cualquier tipo de célula que nuestro cuerpo necesite. Sí, eso podría significar sanar heridas de la médula espinal, pero también que crezca de nuevo cualquier otro tejido del cuerpo que la edad haya dañado: desde el hígado hasta los riñones, pasando por el corazón o el cerebro. Nada se quedaría fuera.
De momento, la combinación de tres genes Yamanaka parece segura en ratones aun cuando lleva activa un año, pero todavía hay mucho trabajo que hacer. Quedan muchas preguntas sin respuesta: ¿podemos suministrar la combinación a todas las células?, ¿causará cáncer a la larga?, ¿deberíamos activar y desactivar los genes para darles un descanso a las células?, ¿funcionará mejor en un tipo de tejidos que en otro?, ¿se les puede administrar a personas de mediana edad, antes de que enfermen, de la misma manera que tomamos estatinas para controlar los niveles de colesterol y así prevenir enfermedades cardiovasculares?
Tengo pocas dudas de que la reprogramación celular será la siguiente frontera en la investigación del envejecimiento. Tal vez un día sea posible reprogramar las células a través de pastillas que estimulen la actividad de los factores OSK o de las TET. Puede que sea incluso más sencillo de lo que parece. Las moléculas naturales estimulan las enzimas TET, incluidos la vitamina C y el alfa-cetoglutarato, una molécula que se crea en la mitocondria estimulada por CR y que cuando se les administra a gusanos nematodos también les alarga la esperanza de vida.
Sin embargo, de momento la apuesta más segura es la terapia genética.
Dado que podría tener un impacto monumental, deberíamos empezar a debatir ya sobre la ética de esta tecnología, antes de que llame a la puerta. La primera pregunta es a quién se le debería permitir usarla. ¿A unos pocos elegidos? ¿A los ricos? ¿A los moribundos? ¿Deberían los médicos dejar que los pacientes con enfermedades terminales la usaran por compasión? ¿Y las personas de más de cien años? ¿De ochenta? ¿O de sesenta? ¿En qué momento merece la pena correr el riesgo para obtener el premio?
Hay una legión de personas dispuestas a «ir a pecho descubierto», voluntarios concienciados de noventa y tantos años, incluso de cien, cuyo cuerpo está destrozado por la enfermedad del envejecimiento. Puedo asegurarte que no son pocos quienes, tras haber avistado un camino de varios años definido por una fragilidad y un dolor crecientes, están dispuestos a arriesgarse por algunos años buenos más; o, en su defecto, por la posibilidad de darles a sus hijos, nietos y bisnietos una vida más larga y sana. Al fin y al cabo, ¿qué tienen que perder?
No obstante, la ética de esta tecnología se complica si reprogramar acaba siendo lo bastante seguro para usarlo de forma preventiva. ¿A qué edad debería suministrarse? ¿Tiene que aparecer una enfermedad antes de recetar el antibiótico activador de la reprogramación? Si los médicos de atención primaria se niegan a ayudar, ¿acudirá la gente a otros países? Si la tecnología pudiera abaratar significativamente los costes en sanidad, ¿debería ser obligatoria?
Y si pudiéramos ayudar a los niños a tener una vida más larga y sana, ¿tenemos la obligación moral de hacerlo? Si la tecnología de reprogramación puede ayudar a repararle el ojo a un niño o a que se recupere de una lesión medular, ¿deberían administrarse los genes antes de que suceda un accidente, a fin de que estén listos para su activación en cualquier momento, tal vez en la ambulancia mediante antibiótico por gotero?
Al fin y al cabo, si la viruela reapareciera en este planeta, los padres que se negaron a vacunar a sus hijos serían los parias de la tierra. Cuando hay tratamientos eficaces y seguros para una enfermedad infantil común, los padres que se niegan a salvarle la vida a sus hijos pueden perder la patria potestad por la doctrina de parens patriae en Estados Unidos, gracias a la cual el Estado la asumiría para proteger al menor.
¿Deberían todos los seres humanos poder decidir si padecer o no el envejecimiento? ¿O debería tomarse esa decisión, como sucede en la mayoría de los casos con las vacunas, según el bien mayor de cada persona y de toda la humanidad? ¿Los elegidos para ser rejuvenecidos tendrán que seguir pagando por las personas que han decidido no hacerlo? ¿Es moralmente reprobable no hacerlo a sabiendas de que te convertirás en una carga antes de tiempo para tu familia?
Hoy son todo preguntas teóricas, pero seguramente no seguirán siéndolo durante mucho tiempo.
A finales de 2018, un investigador chino, He Jiankui, anunció que había ayudado a crear los primeros niños modificados genéticamente, unas gemelas cuyo nacimiento suscitó el debate en los círculos científicos sobre la ética de usar la edición genética para crear «bebés a la carta».
Los efectos secundarios de inducir daños en el ADN de los embriones y la precisión de la edición genética todavía no se entienden bien, razón por la cual la comunidad científica ha tenido una reacción negativa tan extrema. Hay un motivo tácito: los científicos temen que las tecnologías de edición genética, si se usan mal, acaben como los organismos modificados genéticamente y se prohíban por razones políticas o irracionales antes de que se pueda conocer su verdadero potencial.
Puede que estos temores sean infundados. Si se hubiera tenido noticia de los primeros niños modificados genéticamente a principios de siglo, se habría suscitado un debate internacional que habría dominado las noticias durante meses. Los manifestantes habrían asaltado los laboratorios y los presidentes habrían prohibido el uso de la tecnología en embriones. Pero los tiempos han cambiado muchísimo. Dado que las noticias varían cada pocas horas y que la política se ha trasladado a internet, la historia apenas duró unos días; después, el mundo pasó a otras cosas más interesantes.
He Jiankui aseguró que su intención era dar a las gemelas resistencia contra el VIH. Tal vez parezca admirable, pero, tras hacer cálculos, el riesgo no merecía la pena. La probabilidad de contraer el VIH en China es menor de una entre mil. Si He buscaba maximizar los beneficios para la salud para contrarrestar los riesgos del procedimiento, ¿por qué no editar los genes que provocan enfermedades cardiovasculares, unas enfermedades con una probabilidad de causarles la muerte del 50 por ciento? O el envejecimiento, con una probabilidad de causarles la muerte del 90 por ciento. La inmunidad contra el VIH era la más sencilla de editar, no la más impactante.
A medida que estas tecnologías se hacen más accesibles y los padres se preguntan cómo sacarles el máximo partido, ¿cuánto tardará otro científico díscolo en aliarse con los padres más obsesivos para crear una familia genéticamente modificada con la capacidad de resistir los efectos del envejecimiento?
Puede que no tarde mucho en suceder.